Obsah:
MDS, neboli myelodysplastický syndrom, je řazen mezi klonální onemocnění kostní dřeně. MDS je převážně onemocněním starších lidí, (medián věku pacientů je dle různých studií mezi 65-70 lety), může však postihnout i mladší nemocné. Kostní dřeň u zdravého jedince produkuje krevní buňky : červené (erytrocyty) a bílé krvinky (leukocyty) a krevní destičky (trombocyty). Zdravá kostní dřeň produkuje i nezralé krvinky, zvané blasty, které se za normálních podmínek vyvíjejí ve zralé, plně funkční červené a bílé krvinky a krevní destičky. U nemocných s MDS jsou tyto kmenové buňky poškozeny, akumulují se v kostní dřeni popř. mohou mít zkrácenou životnost. Mohou tak rychleji zahynout v kostní dřeni ještě před uvolněním do oběhu, takže ve dřeni je mnoho nezralých buněk (blastů) a v krevním oběhu je málo normálních, zralých krvinek. Nízké počty krevních tělísek nazýváme cytopenie. Jedná se o snížení počtu červených krvinek – anémii, dále snížení počtu bílých krvinek- neutropenii a snížení počtu krevních destiček- trombocytopenii. Dalším typických znakem MDS je porucha tvaru a funkčnosti krvinek, jež se nazývá dysplazie. Přítomnost těchto změněných krvinek je zásadní pro diagnózu MDS. Klinický obraz onemocnění je do značné míry variabilní, což je dáno heterogenitou onemocnění. U části pacientů je onemocnění dlouhodobě stabilní pouze s minimálními projevy, klinický stav některých pacientů vyžaduje opakované krevní převody anebo antibiotickou léčbu, existují i varianty onemocnění jež v krátké době dospějí do akutní myeloidní leukémie (AML). Snížení hladiny červeného krevního barviva (hemoglobinu), jež ústí v chudokrevnost (anemii) je častým projevem MDS. Klinickým projevem anemie je bledost, dušnost, únava a snížení fyzické výkonnosti. Snížení počtu a zhoršení funkce bílých krvinek (leukocytů), jejichž hlavní úloha tkví v obraně organismu, se klinicky manifestuje opakovanými bakteriálními či virovými infekcemi, například zápalem plic či močovou infekcí. U pacientů s MDS převážně klesá počet neutrofilních leukocytů (neutropenie), jež jsou určeny k obraně proti bakteriím. Snížení počtu a zhoršení funkce krevních destiček se klinicky manifestuje zhoršenou krevní srážlivostí. Krácivé projevy často postihují kůži ve formě krevních podlitin, ale vyskytuje se i krvácení z pohlavních orgánů, gastrointestinálního traktu nebo velmi závažné krvácení do mozku. Detailní představa o příčinách a mechanismu vývinu onemocnění není v současnosti dosud vysvětlena. Onemocnění se často vyskytuje v souvislosti s expozicí mutagenním látkám či ozařování. U MDS v současnosti nebyl prokázán přesnos infekčním původcem, postižení v rámci jedné rodiny je velmi vzácné.
Diagnostická vyšetření používaná u pacientů s MDS
(1) Krevní testy
Základním vyšetřením při diagnostice MDS je vyšetření krevního obrazu s manuálním diferenciálním rozpočtem. Krev je odebíraná z periferní žíly, a je stanoven počet jednotlivých krevních buněk, dále je zjištěna velikost a tvar jednotlivých krvinek. V rámci vyšetření krve jsou doplněna biochemická vyšetření informující lékaře o funkci jater, ledvin, endokrinních orgánů a je stanovena hladina železa a hormonu erytropoetinu, vitamínu B12 a kyseliny listové.
(2) Vyšetření kostní dřeně
Pokud základní vyšetření krevního obrazu prokazuje chudokrevnost je vhodné doplnit vyšetření kostní dřeně (KD). Toto vyšetření prokazuje abnormality vývojových stadií buněk krvetvorby v kostní dřeni (vyšetření tvaru buněk + cytochemie na metabolismus železa) a také umožňuje odběry k diagnostice chromozomálních odchylek (cytogenetika). Dále je odebrán vzorek krve ke stanovení imunofenotypizačního rozpočtu jednotlivých krvinek.
Vzorky kostní dřeně jsou získávány při dvou odlišných procedurách – při sternální punkci a trepanobiopsii. Vyšetření kostní dřeně aspirací dřenové krve ze sterna přináší základní informace o vývoji krevních tělísek ve dřeni. Vyšetření spojené s odběrem válečku kosti z hřebene kyčelní kosti (trepanobiopsie) přináší možnost podrobného histologického vyšetření architektoniky kostní dřeně. Vyšetření kostní dřeně nelze provést bez učité invazivity, proto je nutno pacienta před vyšetřením s tímto velmi podrobně poučit a seznámit ho s přínosem vyšetření a potenciálními riziky. Rizika vyšetření kostní dřeně jsou: infekce, hematom a nepříjemné pocity. Při každém zabodnutí jehly přes kůži existuje možnost infekce. Ta je však vysoce nepravděpodobná, pokud je zákrok prováděn sterilním způsobem a sterilní podmínky jsou zachovávány během celé procedury. Po vyšetření se u některých pacientů vytvoří větší modřina (hematom) pod kůží, zvláště při nedostatku destiček. Pacienti, které čeká vyšetření kostní dřeně, se často obávají nepříjemných pocitů. Tyto obavy lze rozptýlit vědomím, že vyšetření kostní dřeně je podobné vytrhnutí zubu po znecitlivění. V obou případech se jedná o odebrání kousku kosti. Pokud je však procedura náležitě provedena, nebude bolest výrazně větší než píchnutí jehly do kůže. Někteří pacienti požadují celkovou narkózu. I ta má však svá rizika a není při tomto vyšetření nutná. Pokud se pacient dále obává, že místní umrtvení nebude stačit, může se podat dodatečný lék.
(3) Doplňkové testy
Virologické vyšetření: stanovení HbSAg, parvoviru B19,HIV Koagulační vyšetření: stanovení parametrů krevní srážlivosti Imunohematologické vyšetření: stanovení protilátek proti erytrocytům a trombocytům Testy na PNH: stanovení CD 59 a CD 55 na erytrocytech a granulocytech (druh bílé krvinky) Molekulárně genetické vyšetření: JAK2 mutace HLA DR 15, HLA typizace
Diagnóza MDS
Klasifikace onemocnění
Heterogenita MDS způsobuje, že průběh toho onemocnění se u jednotlivých pacientů značně odlišuje jak stran klinického obrazu tak i stran prognozy nemoci. Z těchto důvodů je onemocnění členěno dle starší FAB či dle novější WHO klasifikace do jednotlivých podskupin. Mezinárodní prognostický skórovací systém IPSS posuzuje onemocnění podle agresivity nemoci a prognózy pacienta.
FRANCOUZSKO – AMERICKO – BRITSKÁ KLASIFIKACE
Tato klasifikace (FAB) byla vyvinuta po roce 1980 skupinou lékařů se zkušenostmi s MDS z Francie, USA a Velké Británie. Hlavním kritériem bylo procento nezralých buněk v kostní dřeni, přičemž ve zdravé kostní dřeni jich je méně než 2%. Klasifikace FAB rozlišuje pět typů MDS:
- refrakterní anémie (RA)
- refrakterní anémie s prstenčitými sideroblasty (RARS)
- refrakterní anémie s nadbytkem blastů (RAEB)
- refrakterní anémie s nadbytkem blastů v transformaci (RAEB-T)
- chronická myelomonocytární leukémie (CMML)
KLASIFIKACE SVĚTOVÉ ZDRAVOTNICKÉ ORGANIZACE (WHO)
Klasifikace WHO si zachovala některé z prvků klasifikace FAB a přidala další kategoriie, v roce 2008 byla publikována revidovaná WHO klasifikace.
RA/RARS: Refrakterní anémie (RA) a refrakterní anémie s prstenčitými sideroblasty (RARS)
Pacienti v této kategorii mají anémii, která nereaguje (tedy je refrakterní), na léčbu železem či vitaminy. Sideroblasty jsou červené krvinky obsahující granula železa; prstenčité nebo-li věnečkové sideroblasty jsou abnormální sideroblasty s granuly železa rozloženými v okolí jádra.
Refrakterní anémie s prstenčitými sideroblasty či bez nich (RA/RARS) je nejméně škodlivý typ podle klasifikace WHO. Pacienti s MDS typu RARS/RA mají onemocnění omezeno jen na červené krvinky (erytrocyty).
Dysplazie (buněčná atypie) je u tohoto typu jen minimální.
Dle revidované WHO klasifikace z roku 2008 je RA nahrazena RCUID( Refrakterní cytopenie s dysplazií v jedné řadě) kam je zahrnuta kromě refrakterní anemie i refrakterní neutropenie či refrakterní trombocytopenie.
Refrakterní cytopenie s dysplazií ve více řadách (RCMD)
Sem patří pacienti s refrakterními cytopeniemi (trvale nízké počty jakýchkoli krevních buněk; např. refrakterní neutropenie či refrakterní trombocytopenie) a s dysplazií u více typů krevních buněk.
Dále je přítomno méně než 5% blastů či méně než 15% prstenčitých sideroblastů. Pokud mají pacienti s RCMD přes 15% prstenčitých sideroblastů, diagnóza je RCMD-RS.
Refrakterní anémie s nadbytkem blastů (RAEB)
Tato kategorie je rozdělena na dvě dílčí, které se liší počtem blastů v kostní dřeni.
Pacient s RAEB-1 mají 5–9% blastů a pacienti s RAEB-2 pak 10–19% blastů.
Syndrom 5q- (minus)
Syndrom 5q-, byl poprvé popsán před více než 30 lety. Jeho název je odvozen od chromozomu číslo 5, konkrétně od odchylky (delece- chybění) jeho dlouhého raménka (q). Tato delece může být jedinou chromozomální abnormalitou u pacientů s MDS typu 5q-. Pacienti s MDS, kteří mají delece dlouhého raménka chromozomu 5 a k tomu jiné chromozomální abnormity, netrpí syndromem 5q-. Pacienti s tímto syndromem mají refrakterní anémii, při níž je nutná podpůrná péče. Tento syndrom se obvykle vyskytuje u starších žen středního věku, obecně do 65 let věku, s lehkým až středním stupněm anémie a nízkým počtem bílých krvinek (leukopenie), a často s normální až zvýšenou hodnotou destiček. Nemocní se syndromem 5q- většinou přežívají více než 5 let od data diagnózy. V nové WHO klasifikaci je syndrom přejmenován naisolovanou deleci 5q a je ze skupiny RARS přidělen do skupiny RARS-T.
Neklasifikovaný MDS-U
je definován jako pancytopenie s dysplazií pouze v 1 řadě s méně jak % blastů v kostní dřeni či jako přítomnost cytogenetických aberací (odchylek) typických pro MDS bez zjevné dysplazie.
Idiopatická cytopenie neznámého významu (ICUS)
je přetrvávající cytopenie bez známek dysplazie či bez přítomnosti specifických chromozomálních aberací.
Chronická myelomonocytární leukémie (CMML) je dnes řazena do skupiny onemocnění smíšených myelodysplastických/ myeloproliferativních MDS/MPS.
Onemocnění lze rozdělit na CMML 1 s méně jak 10% blastů v KD a více jak 1x 10exp 9 monocytů a přítomností dysplastických změn a CMML 2 s nálezem 10-20% blastů v kostní dřeni.
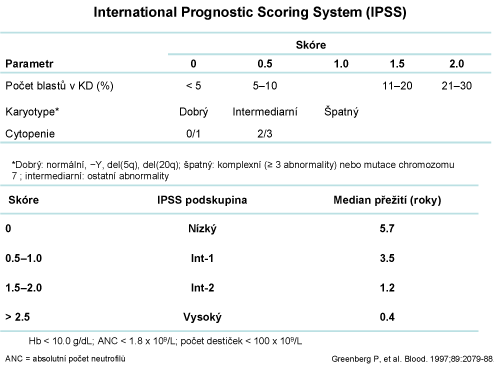
MEZINÁRODNÍ SKÓROVACÍ SYSTÉM (IPSS)
Mezinárodní prognostický skórovací systém IPSS posuzuje onemocnění podle agresivity nemoci a prognózy pacienta.
Každému pacientovi je dle IPSS dán určitý počet bodů jež vyplývají z:
počtu nezralých buněk v kostní dřeni, cytogenetického nálezu chromozomálních aberací a počtu snížení jednotlivých krevních řad viz tabulka1. Celkové skóre IPSS, které pacient dosáhne nám zařadí nemocného do prognostické rizikové skupiny, od níž se poté odvíjí předpoklad délky trvání onemocnění a riziko přechodu do akutní leukémie.
Skóre IPSS stanoví, do které z následujících rizikových skupin pacient patří:
- Nízce riziková skupina: Skóre IPSS je 0.
- Středně riziková skupina 1: Skóre IPSS leží mezi 0,5 až 1,0.
- Středně riziková skupina 2: Skóre IPSS leží mezi 1,5 až 2,0.
- Vysoce riziková skupina: Skóre IPSS je větší než 2,0.
V současnosti je používán i skorovací systém WPSS jež skóruje i pacientovu závislost na transfuzích erytrocytů.
Léčba pacientů s MDS
Léčbu pacientů s MDS je nutné individualizovat v závislosti na individuelních potížích nemocného, na stadiu onemocnění, věku nemocného a na rizikovosti onemocnění.
Pacienti s nízkým a středním rizikem MDS
(1) Sledování bez terapie, vhodné pouze pro pacienty se stabilní nemocí bez nutnosti léčebné intervence
(2) Podpůrná léčba
Transfuze červených krvinek
Substituční terapie, která zmírńuje přiznaky jež vyvolává chudokrevnost. Tato terapie ovlivňuje dušnost, únavu a ovlivňuje riziko nedokrevnosti (ischémie) v kardiovaskulárním systému. Podávání transfuzí je individuelní dle klinických projevů chudokrevnosti.
Transfuze krevních destiček
Substituční terapie jež ovlivňuje krvácivé projevy při snížení počtu trombocytů.
Podávání transfuzí je individuelní dle krvácivých projevů u pacienta.
Antibiotická a antimykotická léčba
Razantní terapie infekcí, profylaktické podávání antimykotik u nemocných s dlouhodobou granulocytopení a rizikem mykotické infekce.
Chelatační léčba
Pacienti, jež jsou závislí na dlouhodobé transfuzní léčbě mohou být ohroženi kumulací železa z aplikovaných transfuzních přípravků. Nadbytečné železo se v organismu ukládá především v játrech a srdci a tyto orgány jsou při přetížení železem dlouhodobě poškozeny. V klinických studiích bylo prokázáno že účinná chelatační léčba výrazně prodlužuje přežití u indikovaných pacientů. Železo odstrańují z těla léky jež železo váží -takzvané cheláty. Chelatační léčbu je doporučeno zahájit u pacientů s hladinou ferritinu v séru nad 1000ug/l což odpovídá podání 20-25 transfuzních jednotek erymasy. Léčba je vhodná pro pacienty se závislostí na transfuzní léčbě a stabilní nemocí bez dalších závažných onemocnění.
V léčbě je k dispozici chelátor Deferoxamin jež je aplikován ve formě kontinuální nitrožilní či podkožní infuze. Dalším chelátorem je Deferasirox, jež je perorální a jež je určen pro pacienty u nichž je terapie deferoxaminem kontraindikována či je neúčinná.
Růstové faktory krvetorby
Erytropoetin
K léčbě příznaků anémie slouží tzv. rekombinantní forma tohoto přirozeného růstového faktoru. Erytropoetin (EPO) povzbuzuje kostní dřeň k tvorbě červených krvinek.
Léčba je nejúčinnější u pacientů, kteří mají hladinu svého vlastního EPO v krvi nižší než 500mezinárodních jednotek na litr, a kteří nepotřebují časté transfuze. Některým pacientům navíc prospívá, pokud dostanou EPO v kombinaci s jinými růstovými faktory, které stimulují kostní dřeň k tvorbě bílých krvinek Kombinace EPO a růstového faktoru bílých krvinek zvaného faktor stimulující kolonie granulocytů (G-CSF) podle všeho nejvíce prospívá anemickým pacientům s MDS z rizikových skupin Nízké či Střední-1.
Filgrastim
Pokud má pacient nízký počet bílých krvinek a trpí přinejmenším jednou infekcí, je vhodné podávání faktoru stimulujícího kolonie granulocytů (G-CSF)-růstového faktorů bílých krvinek. Dva růstové hormony—Faktor stumulující kolonii granulocytů (G-CSF) a faktor stimulující kolonii makrofágů granulocytů (GM-CSF) jsou již k dispozici. Oba jsou podávány pod kůži, a to jednou až sedmkrát týdně.
Romiplostim
Romiplostim je rekombinantní preparát (peptibody) patřící mezi agonisty trombopoietin-receptorů a funguje tak, že stimuluje tyto receptory umístěné na specifických buňkách v kostní dřeni zvaných megakaryocyty, což má za následek zvýšenou tvorbu krevních destiček. Podávání romiplostimu u pacientů s MDS je nyní ve fázi klinických zkoušek.
(3) Imunosupresivní terapie
K terapii imunosupresivními preparáty jsou vhodní pacienti s cytopenií, jež vyžadují léčbu a nejsou vhodní pro transplantaci krvetvorných buněk či pro podávání růstových faktorů. Vhodní jsou pacienti s hypoplastickou formou MDS, přítomnosti klonu buněk , který je přítomen u paroxysmální noční hemoglobinurie (PNH), pacienti s HLA DR 15 znakem a přítomností akcesorního chromozomu 8. Léčba je úspěšnější u pacientů ve věku do 65let věku a s kratší dobou závislostí na transfuzích, bez chromozomálních přídatných změn. Léčebně je podáván antithymocytární globulin a cyklosporin samostatně či v kombinaci s kortikoidy.
(4) Imunomodulační terapie
Lenalidomid je používán v rámci klinických studií a jeho indikací je MDS s isolovanou delecí 5q. Podávání lenalidomidu u těchto pacientů může snížit závislost pacientů na chronické transfuzní terapii.
(5) Alogenní transplantace krvetvorných buněk
U pacientů s MDS s nízkým a středním rizikem je alogenní transplantace krvetvorných buněk indikována u mladších nemocných s těžkou cytopenií, hypoplasií nebo fibrosou kostní dřeně, či sekundární MDS po léčbě chemoterapií či radioterapii. U nemocných se středním rizikem je zoogenní transplantace indikována při přítomnosti více jak 5% blastů v kostní dřeni či přítomnosti nepříznivého karyotypu.
Pacienti s vysokým rizikem MDS
(1) Indukční chemoterapie
Pacienti z vysoce rizikové skupiny dle IPSS či ze skupiny s rizikem střední 2 mají vyšší pravděpodobnost, že jejich MDS přejde do AML. Z tohoto důvodu je nutno zvážit intenzivní chemoterapii, která vyhubí myelodysplastické buňky.Léčba je vhodná pro pacienty mladší 65 let věku s více jak 10% blastů v kostní dřeni bez přítomnosti vážných komorbidit. Intenzivní chemoterapie k léčbě MDS znamená cytotoxickou kombinaci léků podobně jako při léčbě akutní leukémie. Podání indukční chemoterapie má významné nežádoucí účinky. Mezi běžně známé patří ztráta vlasů, vznik slizničních defektů v ústech, nevolnost, zvracení a průjem. Pacient je ve zvýšené míře náchylný k bakteriálním a plísnovým infekcím s nutností podávání antibiotik a antimykotik. Dále pacient opakovaně dostává substituční léčbu transfuzemi červených krvinek a destiček. Pravděpodobnost ústupu MDS pomocí indukční chemoterapie jen asi 30%, proto je u vhodných pacientů vždy zvažována Alogenní transplantace krvetvorných buněk.
(2) Alogenní transplantace krvetvorných buněk
Alogenní transplantace krvetvorných buněk je indikována u nemocných mladších 65let věku s přítomností více jak 10% blastů v kostní dřěni a bez závažných přidružených chorob.
V rámci tohoto výkonu pacient obdrží transfuzi progenitorových krevních buněk (kmenových) z kostní dřeně či z krve od dárce. Transplantaci krve nebo dřeně předchází relativně krátká protirakovinná chemoterapie (buď standardní terapie s vysokými dávkami chemoterapie či režim se sníženou intenzitou). Intenzivní chemoterapie se nazývá myeloablativní, což znamená, že se nevratně ničí buňky kostní dřeně pacienta. Pro pacienty s přidruženými chorobami bývá vhodnější režim se sníženou intenzitou neboli chemoterapie nemyeloablativní. Přestože transplantace krve či kostní dřeně může být přístupem, jenž může MDS vyléčit, lze tento postup použít pouze pro malé procento pacientů, a to vzhledem k často pokročilému věku a nedostatku vhodných dárců. Transplantace má velmi významná rizika. V současnosti je transplantace u MDS vesměs omezena na tzv. alogenní transplantace, kdy pacient dostává transfuzi krvetvorných kmenových buněk od dárce dřeň HLA shodného příbuzného dárce.
(3) Hypometylační látky a inhibitory histon deacetázy
Léčba hypometylačními preparáty a inhibitory histon deacetázy je novým trendem v terapii MDS.
Azacytidin snižuje metylaci DNA. Metylace DNA je součástí procesu vypínání určitých genů, které přispívají ke vzniku rakoviny (např. takzvané geny—supresory nádorů). Snížením methylace DNA azacytidin znovu zapne geny—supresory nádorů v MDS a tak potlačuje vlastní proces MDS.
K terapii těmito preparáty jsou vhodní pacienti se středním 2 či vysokým rizikem nebo se středním 1 rizikem a nepříznivými změnami karyotypu či nemocní s CMML, kteří nejsou vhodní k podání indukční chemoterapie či k alogenní transplantaci krvetvorných buněk. Léčebně je podáván Azacytidin ve formě subkutánní injekce jednou denně po dobu 7 dnů, každé 4 týdny. Cílem léčby je zmenšení závislosti na transfůzích, snížení počtu nezralých buněk a celková stabilizace onemocnění.
Decitabin je další lék z skupiny hypometylačních agens jehož účinnost a bezpečnost je zkoumána v rámci klinických studií.
Podávání inhibitorů histon deacetázy je v součastnosti vyhrazeno pro klinické studie.
(4) Nízkodávkovaná chemoterapie
Podávání nízkých dávek cytosinarabinosidu je alternativou léčby pacientů MDS s vysokým rizikem a pro pacienty s akutní myeloidní leukemií v rámci paliativní léčby.
Další informace o léčbných postupech a centrech hematologické péče jež léčí pacienty s MDS lze získat na adrese: Sdruzeni MDS - www.diagnoza-mds.cz





