Před zahájením onkologické léčby musí být proveden staging onemocnění. U pacientek s karcinomem děložního těla stádia I-IV by před zahájením jakékoliv léčby včetně operačního výkonu měl být léčebný postup konzultován v rámci multidisciplinárního týmu (MDT). Pacientka by měla být znovu konzultována cestou MTD po provedení operace. U nemocných s de novo metastatickým onemocněním (stádium IV v době diagnózy) je primárně preferovaná systémová léčba. Oligometastatické onemocnění (1, maximálně 2 MTS léze) má být léčeno multimodálně. Konkrétní léčebný postup u pacientek s oligometastatickým onemocněním je vhodné konzultovat v rámci MDT. V případě 3 a více metastatických ložisek má být onemocnění léčeno podle standardů pro pokročilé onemocnění, se zařazením lokální léčby dle symptomů.
16.1 Adenokarcinom děložního těla
Základní léčebnou metodou je chirurgická léčba. Standardním chirurgickým výkonem je extrafasciální hysterektomie s bilaterální adnexektomií. Je preferován miniinvazivní (laparoskopický, robotický) přístup.
Radikální hysterektomie je ve stádiu II doporučena jen za účelem dosažení zdravého okraje. Výplachová cytologie není součástí stagingového výkonu.
U endometroidního histotypu G1 stádia IA je možné u pacientek mladších 45 let zvažovat preservaci ovarií po vyloučení přítomnosti nádoru adnex, extrauterinního šíření a genetické predispozice pro vznik maligních gynekologických onemocnění.
U endometroidního histotypu G1 stádia IA bez jakékoliv invaze do myometria je možné zvažovat fertilitu zachovávající léčbu založenou na hormonoterapii. U serózního histotypu, karcinosarkomu a nediferencovaného karcinomu je doporučena stagingová infrakolická omentektomie. Jakákoliv léčba pro adenokarcinom děložního těla včetně fertilitu zachovávajícího přístupu by měla probíhat pouze v onkogynekologických centrech
Biopsie sentinelových uzlin může být provedena u nádorů nízkého a středního rizika metastazování (low-risk a intermediate-risk). Systematická pánevní a paraaortální lymfadenektomie není u této skupiny nádorů nutná.
U nádorů středního – vyššího a vysokého rizika metastazování (high intermediate-risk a high-risk) je možné provést systematickou pánevní a paraaortální lymfadenektomii, biopsie sentinelových uzlin je však akceptovatelnou alternativou. Samostatná RT je určena pro pacientky kontraindikované k operaci a pro pokročilá inoperabilní stadia. Adjuvantní RT snižuje výskyt lokálních recidiv a vaginálních metastáz. Paliativní RT je indikována u pokročilých nálezů, metastáz a u pacientek ve špatném stavu.
Platinové deriváty, taxany a antracykliny jsou nejúčinnější chemoterapeutická agens u této diagnózy. První volbou chemoterapie je kombinace CBDCA/paklitaxel, alternativní režimy CBDCA/docetaxel, cDDP/doxorubicin, event. monoterapie CBDCA či cDDP.
V roce 2023 byla vydána nová verze stagingového systému FIGO a dostupná molekulární klasifikace karcinomu endometria se uvádí jako jeho součást.
16.1.1 Adjuvantní léčba
Adjuvantní léčbu je doporučeno indikovat podle výsledků testování somatických prediktivních a prognostických markerů zahrnujících imunohistochemické vyšetření p53, MSH-6, PMS-2 a mutační analýzu POLE (ε-polymerázy).
Dle ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP (2021) je doporučeno:
Testování p53 u všech rizikových skupin. V případě aberantního typu exprese p53/mutace TP53 musí být provedeno kompletní molekulární testování k vyloučení, že mutace TP53 není sekundárním projevem ultramutovaného stavu při POLE mutaci či v rámci mikrosatelitové instability a jedná se tedy o nádory, jejichž prognóza se odvíjí od POLE mutace nebo mikrosatelitové instability.
Kompletní molekulární testování se stanovením molekulárního subtypu je také doporučeno u všech případů ze skupiny vysokého rizika (high-risk, HR), středního – vyššího rizika (high intermediate-risk, HIR) a středního rizika (intermediate-risk, IR), u kterých může vést k deeskalaci adjuvantní léčby.
Molekulární vyšetření se doporučuje provést z definitivního resekátu, avšak lze ho provést i z diagnostické biopsie, je-li to klinicky relevantní. Součástí histopatologického nálezu vždy musí být i určení přítomnosti nádorové lymfangioinvaze (LVSI, lymphovascular space invasion) s rozdělením do následujících stupňů:
1) nepřítomna (absent)
2) fokální (focal)
3) podstatná (substantial)
Zároveň je doporučeno sjednocené reportování tak, aby pokrývalo všechny alternativy a zachovalo srozumitelnost mezi
jednotlivými pracovišti do 4 molekulárních subtypů následovně:
1) POLE-ultramutovaný (POLE mut)
2) mismatch repair (MMR) deficientní (mikrosatelitově instabilní) (MMRd)
3) s nespecifickým molekulárním profilem (NSMP)
4) p53 mutovaný/abnormální (p53 abn)

Pro pacientky s low-risk nádory není doporučena žádná adjuvantní léčba. Karcinomy stadia I a II s hypermutovanou ε-polymerázou (POLE-ultramutované) lze klasifikovat jako low-risk a jakákoliv adjuvantní terapie může být tedy opuštěna.

U p53 abn karcinomů omezených na polyp bez myometriální invaze (stadium IA bez myometriální invaze) není obecně adjuvantní terapie doporučována (za podmínky kompletního stagingu).



Karcinomy s mutovaným/abnormálním p53 již ve stadiu I při přítomnosti jakékoliv myometriální invaze představují high-risk nádory. Karcinosarkomy (smíšené Mullerianské maligní tumory, MMMT) se považují za high-risk endometriální karcinomy (nikoliv sarkomy).
Brachyterapie pro zvýšení lokální kontroly může být zvážena v rámci adjuvantní léčby high-risk nádorů při podstatné LVSI, při stromální invazi do děložního hrdla nebo ve stadiu IIIB-IIIC.
Pro pacientky s endometriálním karcinomem stadia III-IVA a s patogenní POLE mutací nejsou aktuálně k dispozici data, která by bezpečně podporovala vynechání adjuvantní terapie.
Benefit přidání chemoterapie k zevní radioterapii není jasný u stadií I-II clear cell karcinomu na rozdíl od serózních karcinomů.
* Ve studii PORTEC3 byly užity dva cykly konkomitantní chemoterapie (cDDP) v průběhu EBRT následované 4 cykly kombinace
CBDCA/paklitaxel. Bylo prokázáno 5% prodloužení 5letého přežití ve srovnání s ramenem se samotnou radioterapií. Ve studii
GOG-258 bylo užito stejné schéma konkomitantní chemoradioterapie, ale bylo aplikováno 6 cyklů následné chemoterapie
CDBCA/paklitaxel se stejnými výsledky jako ve studii PORTEC3.
# Řada retrospektivních studií uvádí benefit léčby kombinující radio – a chemoterapii ve srovnání se samostatně použitou modalitou.
Souhrnná analýza studií NSGO-EORTC a MANGO-ILIADE, v nichž bylo užito sekvenční radioterapie a chemoterapie
(v obou možných uspořádáních), uvádí signifikantní prodloužení času do recidivy onemocnění ve srovnání se samotnou radioterapií.
Standardem adjuvantní chemoterapie je 6 cyklů CBDCA/paklitaxel v třítýdenním intervalu. Výsledky této dvojkombinace v rámci klinických studií jsou srovnatelné s trojkombinací TAP (paklitaxel/cDDP/doxorubicin). Dvojkombinace nebyla v rámci těchto studií inferiorní (neprokázala horší RR, PFS ani OS) a měla lepší profil toxicity.

16.1.2 Pokročilé a metastatické onemocnění (stadia III a IV)
Operace je doporučena v připadě možnosti dosáhnout optimální cytoredukce (nulové pooperační reziduum, R0) při akceptovatelné morbiditě a kvalitě života. Ve vybraných případech může být vhodné provedení paliativních operaci ke zmírnění specifických symptomů. V rámci chirurgického výkonu mají být odstraněny pouze zvětšené lymfatické uzliny, systematická lymfadenektomie není doporučena.
Režimy systémové léčby – chemoterapie – jsou shodné s režimy používanými v adjuvanci. Režimem první volby je kombinace CBDCA/Paklitaxel.
Pokud není chirurgicky výkon možný, lze podat systémovou léčbu primárně. Při dobré odpovědi na systémovou léčbu lze zvážit odloženy chirurgicky debulking. U pacientek s pokročilým neresekabilním onemocněním stádia III a IV nebo s rekurentním onemocněním, které nebylo léčené předchozí chemoterapií s výjimkou adjuvantní léčby, a pacientek s reziduální nemocí po provedeném operačním výkonu je indikována kombinovaná léčba chemoterapií a imunoterapií.
U serózního karcinomu a karcinosarkomu je doporučeno stanovení HER-2 a v připadě overexprese možno zvolit terapii kombinací CBDCA/paklitaxel/trastuzumab á 3 týdny s udržovací terapií trastuzumabem do progrese onemocnění. Tato léčba nemá úhradu z veřejného zdravotního pojištění a je tedy nutné schválení RL
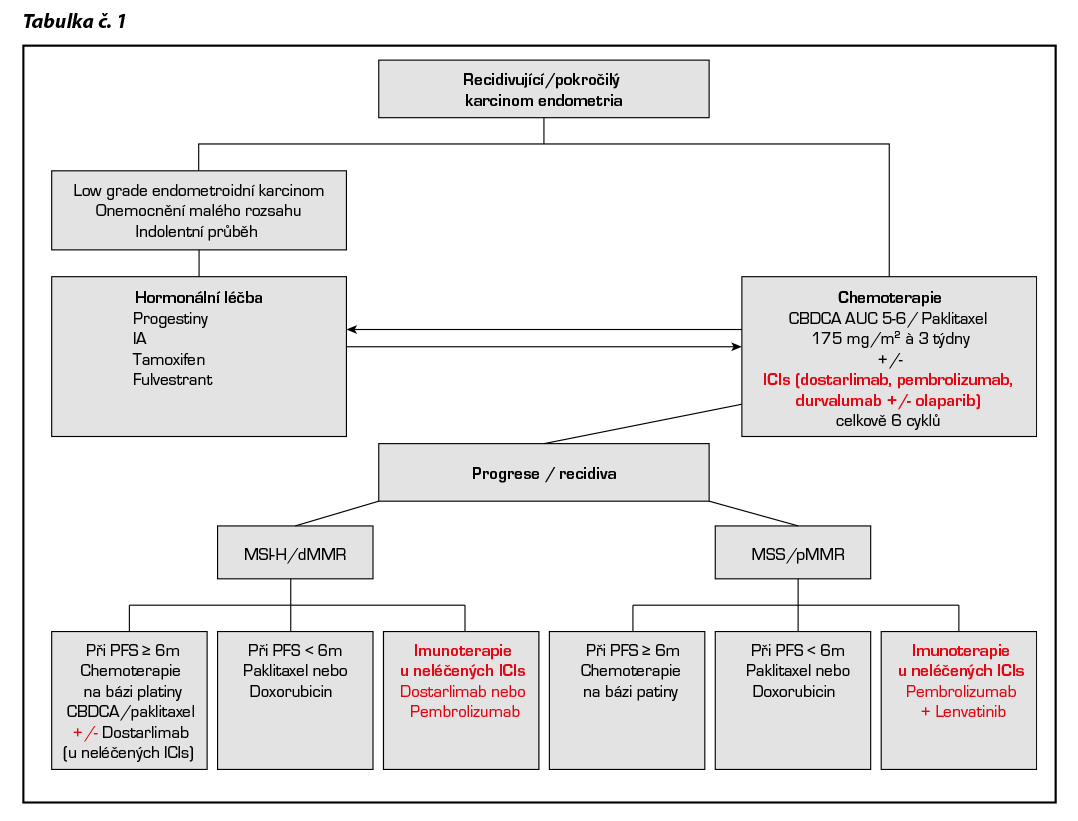
Chemoterapie pokročilého a primárně metastatického onemocnění

Pembrolizumab je v kombinaci s chemoterapií CBDCA/paklitaxel a následně jako udržovací monoterapie indikován v první linii k léčbě primárního pokročilého nebo recidivujícího endometriálního karcinomu u dospělých pacientek, které jsou kandidátky pro systémovou léčbu. V případě, že pacientka byla léčená adjuvantní chemoterapií, lze kombinovanou léčbu s imunoterapií podat nejdříve v odstupu 12 měsíců od jejího ukončení. V této indikaci vyžaduje terapie pembrolizumabem schválení RL.

Dostarlimab v kombinaci s chemoterapií CBDCA/paklitaxel a následně jako udržovací monoterapie je indikován v léčbě dospělých pacientek s recidivujícím nebo pokročilým karcinomem endometria s deficientní opravou chybného párovaní bazí (dMMR, mismatch repair deficient) či vysokou mikrosatelitovou nestabilitou (MSI-H, microsatellite instability high). Stanovení MMRd/MSI-H musí být provedeno pomoci validované testovací metody, jako je IHC, PCR nebo NGS. Terapie dostarlimabem v této indikaci má úhradu ze zdravotního pojištění pro chemonaivní pacientky nevhodné ke kurativní chirurgické léčbě nebo radioterapii a dále pro pacientky s rekurenci onemocnění nejdříve 6 měsíců od ukončeni adjuvantní chemoterapie.

Dostarlimab má i novou registraci – jde o rozšíření registrace u pokročilého nebo rekurentního EC z dMMR na celou populaci (all comers). Pro pMMR pacientky dostarlimab zatím nemá stanovenou úhradu.
Jeho indikace podléhá schválení RL.
Durvalumab +/- olaparib
Durvalumab v kombinaci s chemoterapií CBDCA/paklitaxel a následně jako udržovací monoterapie/kombinovaná terapie durvalumab +/- olaparib je indikován v první linii u všech dospělých pacientek s recidivujícím nebo pokročilým karcinomem endometria, které jsou kandidátky pro systémovou léčbu. U pacientek s dMMR/MSI-H nádory je indikován durvalumab v monoterapii. V této indikaci vyžaduje úhrada durvalumabu schválení RL. U pacientek s pMMR nádory je indikována a kombinována udržovací terapie (durvalumab+olaparib). V případě, že pacientka byla léčená adjuvantní chemoterapií, lze kombinovanou léčbu s imunoterapií podat nejdříve v odstupu 12 měsíců od jejího ukončení. V této indikaci vyžaduje úhrada obou preparátů schválení RL.

16.1.3 Recidivující onemocnění
Pánevní exenterace může být zvážena u pacientek s lokálně pokročilými nádory a při izolovaných centrálních recidivách po RT, u kterých lze očekávat dosažení zdravých resekčních okrajů. Kompletní resekce vzdálených oligometastáz nebo exstirpace uzlin v případě relapsu v pelvických či paraaortálních lymfatických uzlinách může být zvažována v případě, že je technicky možné dosažení nulového nádorového rezidua a s ohledem na pooperační morbiditu. V případě generalizovaných recidiv či v případech, kdy není indikována kompletní resekce je možná kombinovaná chemoterapie a imunoterapie (pacientky nesmí být předléčené předchozí chemoterapií s výjimkou adjuvantní léčby). Dále lze u pacientek zvažovat paliativní chemoterapii, u imunoterapií nepředléčených pacientek i monoterapii checkpoint inhibitory, dále hormonoterapii, cílenou léčbu i BSC.


Neexistuje standard II. linie léčby cytostatiky. V těchto případech je vhodné pacientky zařadit do klinických studií nebo zahájit cílenou léčbu. Na rozhodování o další terapii mají vliv PS, historie předchozí RT na oblast pánve a rozsah diseminace onemocnění. Určitá skupina pacientek, které dosáhly kompletní odpověď na chemoterapii a relabují až po několika měsících od ukončení léčby, by mohla mít benefit z opakovaného léčení platinovým derivátem, preferenčně v kombinaci s taxanem. Pacientky, které relabují časně po iniciální terapii, mají omezené možnosti léčby. Vhodné je včasné zahájení symptomatické a podpůrné léčby.
16.1.3.1 Hormonoterapie jako součást léčby pokročilého a metastatického onemocnění
Zatímco chemoterapie je indikovaná u hůře diferencovaného, rychle progredujícího, symptomatického nebo velkoobjemového onemocnění, pokud se jedná o dobře diferencovaný nádor s delším bezpříznakovým obdobím a pozitivními steroidními receptory (> 1 %), je metodou volby s lepší tolerancí a stejným účinkem hormonoterapie. V rámci hormonoterapie lze použít gestageny (megestrol acetát v dávce 160 mg/denně nebo medroxyprogesteron acetát v dávce 200 mg/denně) nebo tamoxifen či inhibitory aromatáz (letrozol, anastrozol, exemestan).
16.1.3.2 Cílená léčba recidivujícího onemocnění
Kombinace pembrolizumabu s lenvatinibem
Kombinace je indikována k léčbě dospělých pacientek s pokročilým nebo recidivujícím karcinomem endometria s progresí onemocnění při léčbě nebo po předchozí léčbě chemoterapií obsahující platinu, které nejsou kandidátkami pro kurativní chirurgickou léčbu nebo radioterapii, kombinovaná terapie má v této indikací úhradu ze zdravotního pojištění nezávisle na defektu MMR systému (indikována pro dMMR i pMMR nádory). Vzhledem k vyšší toxicitě i nákladům léčby je kombinace vhodná zvláště pro léčbu pMMR (mismatch repair proficient) /MSS (microsatellite stability) nádorů.

Pembrolizumab
Monoterapie v léčbě dospělých pacientek s recidivujícím nebo pokročilým karcinomem endometria dMMR/MSI-H, u kterých došlo k progresi onemocnění při nebo po předchozí léčbě založené na platině v jakémkoli režimu léčby a které nejsou kandidátkami pro kurativní chirurgickou léčbu nebo radioterapii. Přímé srovnání monoterapie pembrolizumabem a kombinace pembrolizumabu a lenvatinibu ve skupině dMMR nádorů neproběhlo. Monoterapie pembrolizumabem vyžaduje schválení revizním lékařem.

Dostarlimab
Monoterapie v léčbě dospělých pacientek s recidivujícím nebo pokročilým karcinomem endometria s deficientní opravou chybného párování bází (dMMR, mismatch repair deficient) či vysokou mikrosatelitovou nestabilitou (MSI-H, microsatellite instability high), u něhož došlo k progresi v průběhu nebo po předchozí léčbě režimem obsahujícím platinu. Stanovení MMRd/MSI-H musí být provedeno pomocí validované testovací metody, jako je IHC, PCR nebo NGS. Monoterapie dostarlimabem vyžaduje schválení revizním lékařem.

16.2 Sarkomy dělohy
Děložní sarkomy zahrnují dle klasifikace WHO 2020: leiomyosarkomy, low grade endometriální stromální sarkomy, high grade endometriální stromální sarkomy, nediferencované děložní sarkomy a adenosarkomy.
Základní léčebnou modalitou je chirurgická léčba. Standardním chirurgickým výkonem je prostá extrafasciální hysterektomie bez morcelace s bilaterální adnexektomií. U leiomyosarkomů je možné dle věku a přání pacientky zachovat ovaria. V případě low grade ESS a sarkomů s pozitivním hormonálními receptory je ve fertilním věku vhodné zvážit bilat. ovarektomii/adnexektomii. Stagingová systematická lymfadenektomie není standardní součástí výkonů, v případě nálezu zvětšených suspektních uzlin se doporučuje jejich exstirpace. Otevřená chirurgie je jednoznačně preferovaným přístupem, laparoskopický výkon je přípustný pouze při zachování integrity dělohy. Fertilitu zachovávající postupy nejsou u děložních sarkomů doporučené. U recidiv onemocnění je vhodné zvážit chirurgické resekce i opakovaně. Obecně všechny pacientky s děložními sarkomy je vhodné zařazovat do klinických studií vzhledem k vzácnosti onemocnění.
Leiomyosarkom těla děložního
Tyto sarkomy představují nejčastější sarkomy dělohy. Obecně pro 1. linii léčby LMS je indikována monoterapie doxorubicinem nebo při pokročilém, inoperabilním či recidivujícím onemocnění kombinace doxorubicin/trabectedin. Následně ve 2. linii pak lze zvážit kombinaci gemcitabin/docetaxel nebo trabectedin (pokud nebyl v 1. linii). V dalších liniích nebo při KI doxorubicinu je alternativou gem/DTIC, pazopanib, ad.
Stádium I – observace, adjuvantní CHT nebo RT není standardem léčby po adekvátním chirurgickém výkonu Stádium II, III, IVA – po optimálním cytoredukčním výkonu zvážit adjuvantní CHT (možno i neoadjuvantní podání), adjuvantní RT při postižení cervixu, parametrií, při pozitivních resekčních okrajích nebo R1/R2
Stádium IVB – chemoterapie +/- paliativní radioterapie

Endometriální stromální sarkomy (ESS)
Low grade ESS, minimální benefit chemoterapie (ke zvážení až ve vyšších liniích léčby), základní systémovou léčbou je hormonoterapie (medroxyprogesteron acetát 200 mg/den nebo megestrol acetát 160 mg/den, inhibitory aromatázy, aGnRH, leuprolid), CAVE: tamoxifen je kontraindikován.
Stádium I – observace, adjuvantní hormonoterapie nebo radioterapie není standardem léčby po adekvátním chirurgickém výkonu, hormonoterapie pouze po morcelaci vzhledem k vysokému riziku relapsu
Stádium II, III, IVA – zvážit hormonoterapii
Stádium IVB – hormonoterapie +/- paliativní radioterapie
High grade ESS a nediferencované děložní sarkomy: doporučení pro léčbu je stejné jako doporučení pro sarkomy měkkých tkání – viz příslušná kapitola.
Stádium I – observace, adjuvantní chemoterapie nebo radioterapie není standardem léčby po adekvátním chirurgickém výkonu, chemoterapie pouze po morcelaci vzhledem k vysokému riziku relapsu
Stádium II, III, IVA – chemoterapie +/- radioterapie
Stádium IVB – chemoterapie +/- paliativní radioterapie

Adenosarkom
Terapie se řídí typem maligní mezenchymální komponenty.
16.3 Molekulární prediktivní vyšetření u karcinomu těla děložního
Testování pacientek pro rozhodnutí o adjuvantní terapii je vysvětleno výše v kapitole adjuvantní léčba.
Pokročilé onemocnění: testování p53 statusu a MMR/MSI. U nádorů s prokázanou mikrosatelitovou instabilitou je nutné dořešení navazujících vyšetření k vyloučení nebo potvrzení Lynchova syndromu. U serózních karcinomů endometria a karcinosarkomů je vhodné stanovit HER2. V neposlední řadě nelze zapomínat na stanoveni ER a PR. Dále je možné NGS testování dle indikace lokálního TMB.
Sledování pacientek po léčbě se řídí doporučením ČGPS ČLS JEP publikovaným 26.4.2019 (Sbírka doporučených postupů č. 7/2019).
Substituční hormonální terapie je po zvážení přínosů a rizik povolena u všech malignit ženského genitálu obecně, jedinou výjimkou je low grade endometriální stromální sarkom.
Literatura:
- Berek JS, Matias-Guiu X, Creutzberg C, et al. FIGO staging of endometrial cancer: 2023. Int J Gynaecol Obstet. 2023 Aug;162(2):383-394. doi: 10.1002/
ijgo.14923. - Concin N, Matias-Guiu X, Vergote I, et al. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Int J Gynecol Cancer.
2021 Jan;31(1):12-39. doi: 10.1136/ijgc-2020-002230. - Concin N, Planchamp F, Abu-Rustum NR, et al. European Society of Gynaecological Oncology quality indicators for the surgical treatment of endometrial
carcinoma. Int J Gynecol Cancer. 2021 Dec;31(12):1508-1529. doi: 10.1136/ijgc-2021-003178. - de Boer SM, Powell ME, Mileshkin L, et al. Adjuvant chemoradiotherapy versus radiotherapy alone in women with high-risk endometrial cancer (PORTEC-3):
patterns of recurrence and post-hoc survival analysis of a randomised phase 3 trial. Lancet Oncol. 2019 Sep;20(9):1273-1285. doi: 10.1016/S1470-
2045(19)30395-X. - Dundr P, et al., Molekulární testování u karcinomu endometria. Společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP. Ceska
Patol 2021; 57(3): 181–187. - Eskander RN, Sill MW, Beffa L, et al. Pembrolizumab plus Chemotherapy in Advanced Endometrial Cancer. N Engl J Med. 2023 Jun 8;388(23):2159-2170. doi:
10.1056/NEJMoa2302312. - Hogberg T, Signorelli M, de Oliveira CF, et al. Sequential adjuvant chemotherapy and radiotherapy in endometrial cancer--results from two randomised
studies. Eur J Cancer. 2010 Sep;46(13):2422-31. doi: 10.1016/j.ejca.2010.06.002. - Makker V, Colombo N, Casado Herráez A, et al. Lenvatinib plus Pembrolizumab for Advanced Endometrial Cancer. N Engl J Med. 2022 Feb 3;386(5):437-448.
doi: 10.1056/NEJMoa2108330. - Matei D, Filiaci V, Randall ME, et al. Adjuvant Chemotherapyplus Radiation for Locally Advanced Endometrial Cancer. NEngl JMed. 2019 Jun 13;380(24):2317-
2326. doi: 10.1056/NEJMoa1813181. - Mirza MR, Chase DM, Slomovitz BM, et al. Dostarlimab for Primary Advanced or Recurrent Endometrial Cancer. N Engl J Med. 2023 Jun 8;388(23):2145-2158.
doi: 10.1056/NEJMoa2216334. - Oaknin A, Bosse TJ, Creutzberg CL, et al. Endometrial cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022
Sep;33(9):860-877. doi: 10.1016/j.annonc.2022.05.009. - Oaknin A, Gilbert L, Tinker AV, et al. Safety and antitumor activity of dostarlimab in patients with advanced or recurrent DNA mismatch repair deficient/microsatellite
instability-high (dMMR/MSI-H) or proficient/stable (MMRp/MSS) endometrial cancer: interim results from GARNET-a phase I, single-arm study.
J Immunother Cancer. 2022 Jan;10(1):e003777. doi: 10.1136/jitc-2021-003777. - O’Malley DM, Bariani GM, Cassier PA, et al. Pembrolizumab in Patients With Microsatellite Instability-High Advanced Endometrial Cancer: Results From the
KEYNOTE-158 Study. J Clin Oncol. 2022 Mar 1;40(7):752-761. doi: 10.1200/JCO.21.01874. - Pautier P, Italiano A, Piperno-Neumann S, et al. Doxorubicin alone versus doxorubicin with trabectedin followed by trabectedin alone as first-line therapy
for metastatic or unresectable leiomyosarcoma (LMS-04): a randomised, multicentre, open-label phase 3 trial. Lancet Oncol. 2022 Aug;23(8):1044-1054.
doi: 10.1016/S1470-2045(22)00380-1. - Pecorelli S. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium. Int J Gynaecol Obstet. 2009;105(2):103-104. doi:10.1016/j.
ijgo.2009.02.012. - Randall ME, Filiaci V, McMeekin DS, et al. Phase III Trial: Adjuvant Pelvic Radiation Therapy Versus Vaginal Brachytherapy Plus Paclitaxel/Carboplatin in
High-Intermediate and High-Risk Early Stage Endometrial Cancer. J Clin Oncol. 2019 Jul 20;37(21):1810-1818. doi: 10.1200/JCO.18.01575. - Ray-Coquard I, Casali PG, Croce S, et al. ESGO/EURACAN/GCIG guidelines for the management of patients with uterine sarcomas. Int J Gynecol Cancer. 2024
Oct 7;34(10):1499-1521. doi: 10.1136/ijgc-2024-005823. - Westin SN, Moore K, Chon HS, et al. Durvalumab Plus Carboplatin/Paclitaxel Followed by Maintenance Durvalumab With or Without Olaparib as First-Line
Treatment for Advanced Endometrial Cancer: The Phase III DUO-E Trial. J Clin Oncol. 2024 Jan 20;42(3):283-299. doi: 10.1200/JCO.23.02132.
