Konference: 2012 XIX. Jihočeské onkologické dny
Kategorie: Radioterapie
Téma: Postery
Číslo abstraktu: 45
Autoři: MUDr. Miluše Dolečková, Ph.D.; Ing. Dana Králová; Ing. Alena Chourová (Studynková); MUDr. Jana Kutová; P. Kučera; Š. Kostohryzová; Jana Rusinová; RNDr. Ing. Petr Berkovský; Jan Capouch; M. Hušková
Úvod
Radioterapie u nádorů hlavy a krku (většinou)
vyžaduje aplikaci vysoké dávky (60-70 Gy) na oblast vysokého rizika
a profylaktickou dávku na oblast nízkého rizika. Problém je
blízkost kritických orgánů, při překročení jejich toleranční dávky
dochází k vážným pozdním komplikacím (radiační myelitida, poškození
zraku, xerostomie...) a poškození zdravých tkání, které se
projevuje časnou a pozdní toxicitou. Vyšší stupeň časných i
pozdních komplikací radioterapie zhoršuje kvalitu života
pacienta.
Cílem radioterapie u tohoto komplexu diagnóz je
odstupňovat a eskalovat dávku do různě rizikových cílových objemů s
minimalizací dávky na zdravé tkáně (tvarování isodózy).
Nové technologie v radioterapii umožňují
přiblížit se ke splnění cíle.
IMRT (intensity-modulated radiotherapy) dovoluje eskalovat dávku a
snižuje akutní i pozdní toxicitu radioterapie u nádorů hlavy a
krku. Výhody plánovacího systému jsou v biologické kalkulaci
založené na optimalizaci distribuce dávky a větším šetření zdravých
tkání a rizikových orgánů ve srovnání s konvenční optimalizací
dávky.
Metoda
Na onkologickém odd. Nemocnice v Č. Budějovicích
se k ozařování nádorů hlavy a krku od r. 1993 používala 3DCR (3D
konformní radioterapie) na lineárním urychlovači Clinac 2100 a od
r. 2008 také technika IMRT na urychlovači Clinac 2100 C/D. V obou
případech je pacient v supinační ozařovací poloze, hlava, většinou
i s rameny, je fixovaná maskou s termoplastického materiálu. Obě
techniky jsme porovnávali u pacienta, kde klasickou ozařovací
technikou bylo velmi obtížné dosáhnout plánované dávky v oblasti
mezi orbitami a oblasti jejich mediální stěny.
Pacient s karcinomem dutiny nosní (T4 N3 M0) po
exstirpaci tumoru rhinobaze, pravé orbity, klínové dutiny, resekce
tumoru ve frontálních lalocích, pravostranné blokové disekci
krčních uzlin. Histologicky se jednalo o nekrotický nediferencovaný
solidní karcinom.
Podle MR jde o maligní tumorósní expanzi vycházející z pravé nosní
dutiny, šířící se přes střední čáru do levé nosní dutiny,
destruující skelet a prorůstající do pravé očnice a přední jámy
lební vpravo, dorzálně dosahuje ve sfenoidální kosti až k
hypofýze.
Adjuvantní radioterapii kromě operace předcházely 2 série
chemoterapie (cis Pt+FTU) s následným zmenšením tumoru.
Pacient byl naplánován klasickou metodou 3DCR a technikou
IMRT.
K porovnání obou ozařovacích technik bylo využito DVH (dose volume
histogram) a programu BioGray.
Technika
IMRT u pacienta zajistila simultánní eskalaci dávky podle
zakreslených PTV (planning target volume): PTV54 (profylaktické
ozáření nepostižených lymfatických krčních uzlin) d.l.d. 1,8 Gy do
54
Gy, PTV60 (lem kolem PTV63 s možným šířením nádoru) s d.l.d. 2 Gy
do 60 Gy, PTV63 (tumor v oblasti frontálních laloků, nasofaryngu,
mediální a zadní stěny orbity vpravo, dutiny nosní a sfenoidální,
ethmoidů) s d.l.d. 2,1 Gy do celk.d. 63 Gy. Simultánní eskalaci
dávky (SIB simultaneously integrated boost) dosáhneme volbou dávky
pro frakci (1,8 Gy, 2,0 Gy, 2,1 Gy).
Klasická metoda ozařování nádorů hlavy a krku 3DCR formou asymetrického pole:
- 2 kontralaterální pole X záření 6MV pokrývají oblast primárního tumoru i oblast horních krčních uzlin, d l.d. 2 Gy do celk.d. 60 Gy. 1 přední pole X záření 6MV je použito k ozáření dolních krčních uzlin s vykrytím míchy a orgánů ve střední ose (Pb blok), d l.d. l,8 Gy do celk.d. 54 Gy.
- Možnost asymetrie v ose X a Y (nezávislá pohyblivost clon v ose X a Y) vylučuje problémy se separací polí (hot a cold spots) a to díky vyloučení divergence svazku v rovině centrálního paprsku a tím je umožněna homogennější distribuce dávky v těchto oblastech. Dovoluje aplikovat kurativní dávku na spádové lymfatické oblasti a nepřesáhnout toleranční dávku na míchu a to díky kombinaci nízkoenergetického X záření (6MV) a elektronového záření (adekvátní energie) po dosažení dávky 38-42Gy na míše.
Výsledky
1. Distribuce dávky
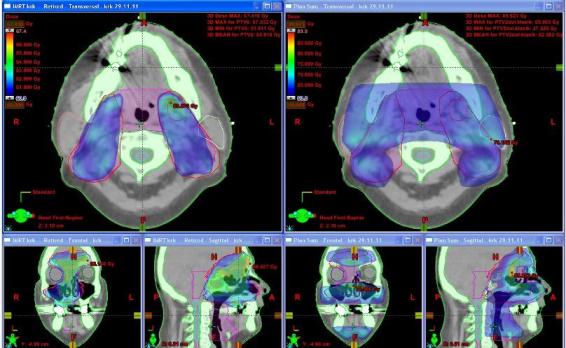
Obr. č. 1: Distribuce dávky (60 Gy a více) v transverzálním skenu v oblasti horních krčních uzlin a ve frontální a sagitální rekonstrukci u techniky IMRT (vlevo) a u 3DCR (vpravo).
Na frontální rekonstrukci plánu pro IMRT (obr. č. 1 vlevo) je patrné dobré pokrytí tumoru v oblasti vnitřní orbity vpravo a přilehlé nosní dutiny zvolenou dávkou na rozdíl od 3DCR (obr. č. 1 – vpravo), kde je toto pokrytí nedostatečné. Na frontálních i sagitálních rekonstrukcích (obr. č. 1 vlevo) v barevném mapování dávky je vidět eskalovanou dávku v místech tumoru (zelená barva).
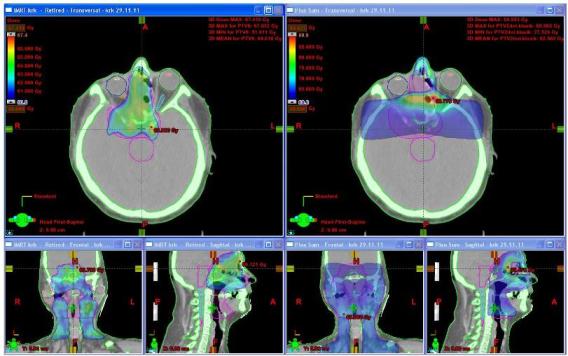
Obr. č. 2: Distribuce dávky (63 Gy a více – zelená, 60 Gy a více modrá ) v transverzálním skenu v oblasti orbity, dutiny nosní a sfenoidální, ethmoidů a ve frontální a sagitální rekonstrukci u techniky IMRT (vlevo) a u 3DCR (vpravo).
2.
3. CI
Pro optimalizaci a analýzu šetření okolních zdravých tkání slouží index konformity (CI).
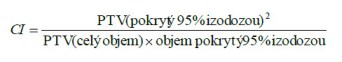
U námi hodnoceného pacienta byl CI pro IMRT plán 0,79 což odpovídá vysoké konformitě techniky, na rozdíl od 3DCR, kde CI byl 0,54.
4. DVH
U 3DCR 98% předepsané dávky pokrývalo 95% PTV60 a 98% pokrývalo 95% PTV54.
U IMRT 100% předepsané dávky pokrývalo 95% PTV63, 100% předepsané dávky pokrývalo 95%
PTV60 a 100% pokrývalo 95% PTV54.
Pokrytí PTV plánovanou dávkou je u IMRT techniky lepší.
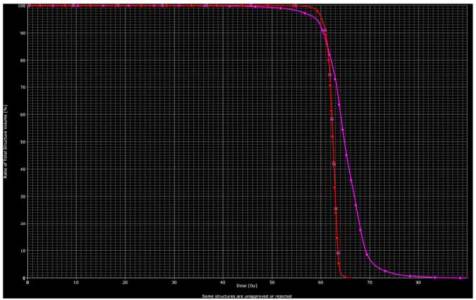
Graf č. 1: DVH pro PTV60IMRT (červená křivka) a PTV603DCR (fialová křivka)
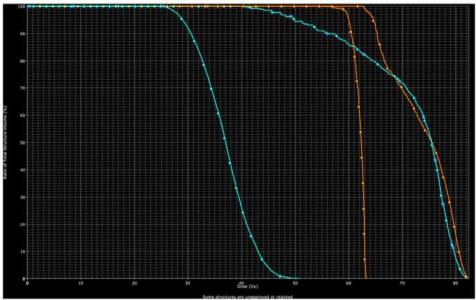
Graf č. 2: DVH pro pravý optický nerv (oranžové křivky) a pro levý optický nerv (modré křivky). IMRT technika značena 3DCR technika
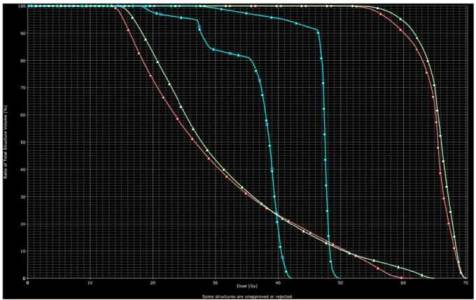
Graf č. 3: DVH pro pravou parotidu (oranžové křivky), levou parotidu (žluté křivky) a pro míchu (modré křivky). IMRT technika značena 3DCR technika
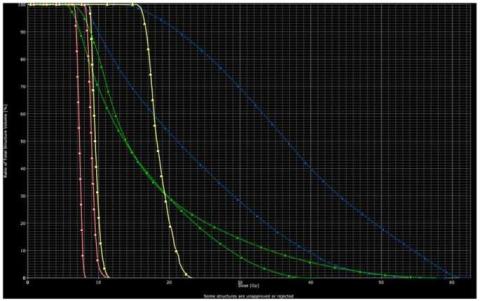
Graf č. 4: DVH pro levou oční čočku (oranžové křivky) a pro pravou oční čočku (žluté křivky), levé oko (zelené křivky) a pravé oko (modré křivky). IMRT technika značena 3DCR technika
5. Radiobiologické hodnocení (výpočty provedeny v programu BioGray ve spolupráci s Doc. RNDr. P. Matulou CSc.)
TCP (tumor control probability) pro IMRT (43,6%) a pro 3DCR (47,8%) bylo srovnatelné a odpovídalo literárním údajům pro T4. Prostorové rozložení dávky v PTV bylo při IMRT výrazně příznivější než při 3DCR (prostorové údaje nejsou při výpočtech v programu BioGray brány v úvahu).
NTCP (normal tissue complication probability)
Tab. č. 1
|
IMRT |
3DCR |
|
|
Optické nervy |
0 a 4,4% |
97% oba |
|
Parotidy |
35% a 37% |
100% obě |
|
Mozkový kmen |
2,6% |
9,3% |
|
Mícha |
0,8% |
3,2% |
|
Oční čočky |
0% a 19% |
0% obě |
|
Oči (sítnice) |
5% a 26% |
0% a 10% |
Pro optické nervy a parotidy byla tedy NTCP při IMRT akceptovatelná, při 3DCR se pravděpodobnost pozdních komplikací téměř blížila 100%. Mozkový kmen a mícha byly šetřeny u obou technik, u IMRT více. Oči a oční čočky vpravo byly více zasaženy při IMRT technice vzhledem k tomu, že tumor prorůstá mediální stěnou do orbity a při 3DCR je tato oblast poddávkovaná.
Diskuze
Strategie dávkové eskalace nám umožní „mapování“ tumoru nejvyšší dávkou i s radiobiologickým navýšením a naopak oblasti, kde bude dostačující dávka p rofylaktická, budou mít dávku adekvátně nižší. Toto mapování dávky „každému co patří“, na rozdíl od téměř homogenního ozáření při klasické radioterapii, umožní lepší zvládnutí tumoru a menší reakci na zdravých tkáních ať časnou či pozdní. S tím souvisí délka přežití a komfort pacienta v průběhu léčby a po léčbě.
Srovnání IMRT a 3DCR ve vztahu ke kvalitě života bylo hodnoceno ve 14 studiích, statisticky signifikantně bylo zlepšení u IMRT zejména u xerostomie, suchosti dutiny ústní, přilnavých slin a dysfagií (Tribius S. 2011)(1).
Nejvýznamnější faktor pro použití IMRT u epiteliálních nádorů hlavy a krku je ozařovaný objem (Sher DJ.,et al, 2011)(2).
Chatterjee S. et al (2011) hodnotil IMRT a HT (helical tomotherapy) s klasickými ozařovacími technikami u nádorů hlavy a krku se závěrem, že IMRT vytváří větší pravděpodobnost nekomplikovaného zvládnutí tumoru a to pro možnost dávkové eskalace(3).
Dragovic AF. et al, (2011) hodnotil různé frakcionační režimy u nádorů hlavy a krku – průměrná týdenní dávka 10,0Gy byla spojená s lokoregionální kontrolou ve 2 letech u pacientů léčených pouze RT (80.9% vs 60.9%, p = 0.006), ale neměla přínos pro pacienty s konkomitantní chemoradioterapií (75.3%vs 77.3%, p = 0.77(4).
Jellema et al (2010) hodnotil dávku na slinné žlázy ve vztahu ke xerostomii: při střední dávce 30 Gy na parotidu bylo odhadnuto snížení rizika xerostomie o 20%, jestliže střední dávka na submandibulární žlázu byla 0 Gy v porovnání s 50Gy. Podobně při chirurgickém přesunu submandibulárních žláz mimo ozařovaný objem s nejvyšší dávkou bylo popsáno šetření 30% stimulované funkce slinění před léčbou(5).
Celý mozkový kmen může být léčen 54Gy s pouzitím konvenční frakcionace s omezeným rizikem vážných nebo trvalých neurologických jevů. Menší objemy mozkového kmene (1-10ccm) mohou být ozářeny maximální dávkou 59Gy á 2Gy. Zdá se, že se riziko výrazně zvyšuje při dávkách 64Gy (Mayo C., Martel K., Marks LB., et al. QANTEC, 2010)(6).
Při konvenční frakcionaci 2 Gy denně obsahující celý průměr míchy celková dávka 50 Gy, 60 Gy a 69 Gy odpovídá 0,2%, 6% a 50% četnosti myelopatie. Zdá se, že pro reiradiaci celého průměru míchy při 2 Gy denně se po předcházející konvenčně frakcionované léčbě tolerance na míchu zvyšuje nejméně o 25% 6 měsíců po úvodním kurzu radioterapie (založeno na studiích na zvířetech i na lidech) (Kirkpatrick JP., van der Kogel AJ., Schultheiss TE., QANTEC, 2010)(7).
Parsons (2010) popsal zvyšující se riziko RION (radiation-induced optic neuropathy) se zvyšujícím se věkem. U nikoho z 38 pacientů v rozmezí 20-50 let se nevyvinula RION, přestože optický nerv byl ozářen 60Gy u 58% a 70Gy u 26% pacientů. Naproti tomu bylo riziko RION popsáno u starších pacientů. Pro pacienty s dávkami 60Gy byl výskyt 26% pro skupinu 50-70 let a 56% pro skupinu 70let. Podobně Belhandare popisoval RION v 0%, 4%, 13% a 14% pro pacienty věku <20, 20-50, 51-70 a 70let(8).
Závěr
IMRT snižuje akutní i pozdní toxicitu radioterapie u nádorů hlavy a krku. Výhody plánování jsou v biologické kalkulaci založené na optimalizaci distribuce dávky a ve větším šetření zdravých tkání a rizikových orgánů ve srovnání s konvenční optimalizací dávky. Vzhledem k dobré distribuci eskalované dávky záření by se mělo zlepšit i zvládnutí tumoru oproti klasické ozařovací technice.
Literatura
- Tribius S, Bergelt C. Intensity-modulated radiotherapy versus conventional and 3D conformal radiotherapy in patiens with head and neck cancer: is there a worthwhile quality of life gain? Cancer Treat. Rev. 2011 (7), 511-519
- Sher DJ., Seville BA., Chen AB., Schrag D. Predictors of IMRT and conformal radiotherapy of use in head and neck squamous cell. Int. J. Radiat. Oncol. Biol. Phys. 2011, 81 (4), 197-206
- Chatterjee S., Willis N., Locks SM., Mott H., Kelly CG. Dosimetric and radiobiological comparison of helical tomotherapy, forward-planned intensity-modulated radiotherapy and two –phase conformal plans for radical radiotherapy treatment of head and neck squamous cell carcinomas. The British Journal of Radiology, 84, 2011, 1083-1090
- Dragovic AF, Bonner JA, Spenser SA., Nabell LM., Caroll WR, Caudell JJ. Impact of average weekly dose of radiation dutiny radiotherapy alone or chemoradiotherapy in head a nd neck cancer. Head Neck. 2011, 33(11): 1551-6
- Deasy JO., Moiseenko V., Marks L., QANTEC – Radiotherapy Dose-Volume Effects on Salivary Gland Function. Int. J. Radiat. Oncol. Biol. Phys. 2010, 76(3), 58-63.
- Mayo C., Yorke E., Merchant TE., QANTEC – Radiation Associated Brainstem Injury. Int. J. Radiat. Oncol. Biol. Phys. 2010, 76(3), 36-41.
- Kirkpatrick JP., van der Kogel AJ., Schultheiss TE., QANTEC – Radiation Dose-Volume Effects in the Spinal Cord. Int. J. Radiat. Oncol. Biol. Phys. 2010, 76(3), 42-49.
- Mayo C., Martel K., Marks LB., et al. QANTEC Radiation Dose-Volume Effects of Optic Nerves and Chiasm. Int. J. Radiat. Oncol. Biol. Phys. 2010, 76(3), 28-35.
Datum přednesení příspěvku: 19. 10. 2012
