Konference: 2012 XXXVI. Brněnské onkologické dny a XXVI. Konference pro sestry a laboranty
Kategorie: Onkologická diagnostika
Téma: 22. Základní a aplikovaný výzkum v onkologii
Číslo abstraktu: 226
Autoři: Marcela Vlčnovská; Ing. Kristýna Šmerková; Ing. Simona Dostálová; Ing. Jiří Sochor, Ph.D.; doc.Ing. René Kizek, Ph.D.
Klíčová slova:
magnetizovatelné částice, izolace, nukleové kyseliny, square
wave voltametrie
Úvod
Magnetizovatelné mikro- a nanočástice (MPs) nacházejí uplatnění v široké škále biomedicínských a biotechnologických oborů, kde se využívají pro cílený transport léčiv, zobrazování pomocí magnetické rezonance, magnetofekci, izolaci biomolekul, reparaci tkání nebo například pro značení buněk [1]. Při výrobě MPs se pro tyto účely využívají oxidy železa, běžným materiálem pro syntézu MPs je magnetit (Fe3O4) a maghemit (γ-Fe2O3). Použití MPs je pak založeno na biodegradabilitě a biokompatibilitě oxidů železa [2]. Díky svým paramagnetickým nebo superparamagnetickým vlastnostem reagují MPs na vnější magnetické pole, čehož se využívá pro separaci specifických látek z roztoku. V závislosti na změně vnějšího magnetického pole lze částice a na ně navázané molekuly snadno nahromadit nebo rozptýlit v roztoku [3]. Další výhodou je, že povrch MPs je modifikovatelný, a to vytvořením několika vrstev atomů organického polymeru, anorganického kovu nebo může být povrch upraven oxidy (oxid křemičitý, oxid hlinitý). Na takto upravené MPs lze navázat další bioaktivní molekuly (streptavidin, avidin) nebo jsou přímo použity pro magnetickou separaci látek [4].
Izolace nukleových kyselin je jedním z nejdůležitějších nástrojů pro molekulární biologii. Před nástupem moderních technologií byla jejich separace časově a technicky náročná. Byla založena na několika extrakčních a odstřeďovacích krocích, kdy docházelo ke kontaminaci a degradaci nukleových kyselin a navíc k malým výtěžkům [5]. Pro izolaci DNA se využívají částice s funkčním povrchem na základě silanolových skupin, samotná magnetická separace je založena na elektrostatické interakci DNA s povrchem částic. Tato separace je jednoduchá a velmi účinná [6].
Při diagnostice nádorových onemocnění a karcinogeneze je často nutná izolace genomové DNA z klinického materiálu. Kromě nádorových buněk se ve vzorku nacházejí také buňky zdravé, je tedy nutné izolovat maximální množství DNA pro následnou polymerázovou řetězovou reakci (PCR), aby byla zajištěna amplifikace DNA i z případných nádorových buněk. Amplifikovaná DNA dále slouží pro diagnostiku nádorových onemocnění pomocí analýzy mutací [7]. MPs se také mohou využít pro izolaci genomové DNA lidského papilomaviru (HPV) z dutiny ústní, což dále vede k usnadnění a automatizaci diagnostiky rakoviny úst [8]. MPs mají potenciálně významnou roli v diagnostice karcinomů, a proto je nezbytné optimalizovat metody magnetické separace pro tyto účely.
Cílem této práce bylo navržení a optimalizace vhodné metody vazby DNA na magnetické částice, která by byla použitelná při diagnostice nádorových onemocnění. Stanovení výtěžnosti izolace DNA bylo provedeno elektrochemicky, pomocí square wave voltametrie.
EXPERIMENTÁLNÍ ČÁST Materiál
Pro izolaci vzorku DNA (PCR produkt o délce 500 párů bází) byly použity magnetizovatelné částice Dynabeads® MyOne™ SILANE (Dynal AS, Norsko), dodávané v uchovávacím roztoku, kterým byla voda s příměsí 0,02 % NaN3. Experimenty byly prováděny ve sterilním prostředí DNA/RNA UV-cleaner boxu UVT-S-AR (Biosan, Lotyšsko). K promývání částic před imobilizací a po ní byly použity tyto roztoky: fosfátový pufr I (0,1 M NaCl + 0,05 Na2HPO4 + 0,05 M NaH2PO4), Taq pufr o pH 8,3 (10 mM Tris-HCl, 50 mM KCl, 1,5 mM MgCl2) (BioLabs,USA), H2O a 5 M NaCl. Imobilizační roztok byl o složení 100 mM Na2HPO4 + 100 mM NaH2PO4; 2,5 M NaCl; 0,6 M guanidin thiokyanát; 0,15 M Tris HCl (pH 7,5).
Jako eluční roztoky byly použity: fosfátový pufr II (0,2 M NaCl + 0,1 Na2HPO4 + 0,1 M NaH2PO4), Tris-EDTA (10 mM Tris + 0,1 mM EDTA), Tris-HCl (10 mM Tris-HCl). Měření probíhalo v acetátovém pufru (0,2 M CH3COOH + 0,2 M CH3COONa).
Všechny chemikálie byly v ACS čistotě pořízeny od firmy Sigma-Aldrich Chemical Co. (USA), pokud není uvedeno jinak.
Metody
Magnetická separace
Celá magnetická separace se skládá celkem ze čtyř kroků: promývání, imobilizace, promývání a eluce. Jednotlivé kroky jsou dále popsány.
Promývání
Do 16 mikrozkumavek bylo napipetováno 10 μl magnetizovatelných částic resuspendovaných v uchovávacím roztoku. Mikrozkumavky byly umístěny na magnetický stojánek po dobu dvou minut. Částice se díky magnetu ve stojánku shlukly ke stěně mikrozkumavky a byl odpipetován přebytečný uchovávací roztok tak, aby při tom nebyly nasáty částice. Poté k nim bylo přidáno 20 μl promývacího roztoku a částice byly manuálně promíchány. Znovu následovalo umístění částic na magnetický stojánek, odstranění promývacího pufru a opětovné promytí. Tentokrát však byly částice resuspendovány automaticky na přístroji Multi spin MSC-6000 (Biosan, Lotyšsko) při třepání na nejtěžším stupni po dobu 20 s a následné centrifugaci při rychlosti 1600 RPM. Částice byly takto promyty třikrát.
Imobilizace
Po odstranění promývacího roztoku bylo do mikrozkumavky k částicím přidáno 10 µl PCR produktu a 10 µl imobilizačního roztoku. Imobilizace byla prováděna po dobu 15 minut na přístroji Multi spin MSC-6000 za třepání na nejtěžším stupni po dobu 20 s a centrifugaci při rychlosti 1600 RPM.
Promývání
Po ukončení imobilizace byly částice opět třikrát promyty výše popsaným způsobem.
Eluce
Následně bylo k částicím s navázanou DNA přidáno 30 µl elučního roztoku a mikrozkumavka byla umístěna na Thermomixer 5355 (Eppendorf, Německo). Eluce probíhala po dobu 5 minut při 85 °C za současného třepání. Po ukončení eluce byly zkumavky vloženy na dobu 2 minut na magnetický stojánek a roztok obsahující DNA byl odsán do nových mikrozkumavek.
Elektrochemická detekce DNA
Stanovení DNA bylo provedeno elektrochemicky, na analyzátoru AUTOLAB (EcoChemie, Nizozemsko) propojeném s VA Stand 663 (Metrohm,Švýcarsko) pomocí adsorptivní přenosové techniky. Pro měření bylo použito standardní tříelektrodové zapojení, kde byla jako pracovní elektroda použita visící rtuťová kapková elektroda (HMDE), pomocnou byla platinová elektroda a jako referentní sloužila argentchloridová elektroda. Na parafilm byla napipetována 5 μl kapka vzorku, ke které byla přiložena pracovní rtuťová elektroda a probíhala akumulace vzorku po dobu dvou minut na povrch elektrody. Následně byla pracovní elektroda omyta v destilované vodě a přesunuta do roztoku elektrolytu (acetátový pufr, pH 5), kde došlo pomocí square wave voltametrie (SWV) k analýze DNA za následujících parametrů: počáteční potenciál 0 V, koncový potenciál – 1,8 V, potenciálový krok 0,00459 V, amplituda 0,02505 V a frekvence 280 Hz. Ze vzniklého záznamu byla odečtena výška píku, jejíž hodnoty byly vyneseny do grafu. Z každého experimentu byl pík o nejvyší hodnotě určen jako 100 % a ostatní hodnoty s ním byly porovnávány.
Výsledky a diskuse
Použití MPs je velmi specifická a jednoduchá technika pro izolaci DNA. Aby bylo dosaženo maximálního výtěžku izolované DNA, došlo k optimalizaci složení použitých promývacích a elučních roztoků.
Optimalizace promývacích roztoků
Pro zajištění nejvyšší výtěžnosti izolované DNA bylo optimalizováno použití promývacích roztoků (fosfátový pufr I, Taq pufr, H2O, 5 M NaCl) před imobilizací a po ní. Při promývacích krocích bylo nejvyšší účinnosti izolace dosaženo, pokud se částice promývaly po imobilizaci amplikonů pomocí 5 M roztoku NaCl a před imobilizací pomocí fosfátového pufru I (obr. 1A). Pro relativní srovnání promývacích roztoků byla tato maximální hodnota výtěžnosti brána jako 100 %. Při použití fosfátového pufru I a H2O před imobilizací byla účinnost purifikace DNA obdobná, ale lepší opakovatelnosti měření bylo dosaženo u fosfátového pufru, kdy byla směrodatná odchylka stanovení (RSD) pro 5 měření 10,4 %. Při použití H2O byla RSD 18,1 %. Opakovatelnost byla dále zlepšena při promytí částic před imobilizací Taq pufrem (RSD 2,7 %) nebo 5 M roztoku NaCl (RSD 2,6 %), ale výtěžek izolace byl za těchto podmínek nižší než v předchozím případě (34-37 %). Nejlepší opakovatelnosti měření bylo dosaženo při promytí částic před imobilizací Taq pufrem a po imobilizaci fosfátovým pufrem I (RSD 1,2 %, obr. 1D), ale výtěžek izolace byl za těchto podmínek nízký (23,5 %). Naopak nejhorší opakovatelnosti měření (RSD 18,1 %) bylo dosaženo promytím částic před imobilizací pomocí H2O a po imobilizaci pomocí 5 M roztoku NaCl.
Optimalizace složení elučního roztoku
Zvýšení účinnosti izolace DNA bylo také dosaženo optimalizací složení elučního roztoku, kdy byly porovnávány roztoky fosfátového pufru II a Tris-EDTA o pH 6,5 a Tris-HCl a Tris-EDTA o pH 9. Z výsledků je zřejmé, že vyšší účinnosti izolace bylo dosahováno při použití roztoku Tris-EDTA (obr. 2) ve srovnání s ostatními roztoky. Relativní maximální hodnota výtěžnosti (100 %) byla stanovena u roztoku Tris-EDTA o pH 9. U stejného roztoku o pH 6,5 byla výtěžnost 36,9 %. Vliv pH na izolaci DNA byl dále ověřen. Nejlepší opakovatelnost je při použití roztoku Tris-HCl (RSD 1,4 %) v porovnání s Tris-EDTA o pH 9 (RSD 20,5 %), ale výtěžnost je nízká (15,2 %).
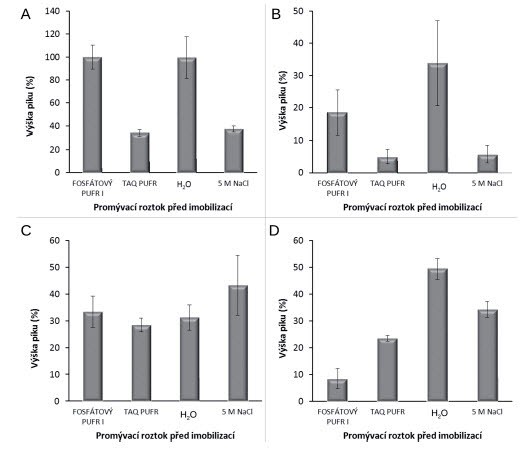
Obr. 1. Vliv promývacích roztoků před imobilizací a po ní na množství izolované DNA. V jednotlivých grafech je znázorněna závislost všech promývacích roztoků před imobilizací vždy na jednom promývacím roztoku po imobilizaci.
Obrázek A: po imobilizaci byl použit 5M roztok NaCl; B: po imobilizaci byla použita H2O;
C: po imobilizaci byl použit Taq pufr; D: po imobilizaci byl použit fosfátový pufr I.
Optimalizace pH elučního roztoku
Dále bylo optimalizováno pH elučního roztoku Tris-EDTA. Z výsledků je zřejmé (obr. 3), že se zvyšujícím se pH bylo dosaženo vyšší výtěžnosti izolace. Nejvyšší relativní účinnost izolace (100 %) byla zjištěna u hodnoty pH 9,6, ale při vyšších hodnotách pH došlo k výraznému zhoršení opakovatelnosti měření (RSD 61,4 %). Obdobně při použití roztoku o příliš nízkém pH byla také opakovatelnost zhoršena. Optimální tedy bylo použití roztoku o pH 9, kdy bylo dosaženo dobré výtěžnosti izolace (78 %) i opakovatelnosti měření (RSD 15,8 %), ačkoliv nejlepší opakovatelnosti měření (RSD 11,8 %) bylo dosaženo při použití elučního roztoku o pH 8, ale výtěžek izolace byl nízký (76,9 %).
Při promývání bylo nejvyšší výtěžnosti izolované DNA dosaženo za použití fosfátového pufru I před imobilizací a 5 M NaCl po ní. Eluce DNA z magnetických částic probíhala nejlépe v prostředí roztoku Tris-EDTA o pH 9.
Bylo optimalizováno složení promývacích roztoků a elučního roztoku, čímž bylo maximalizováno množství izolované DNA.
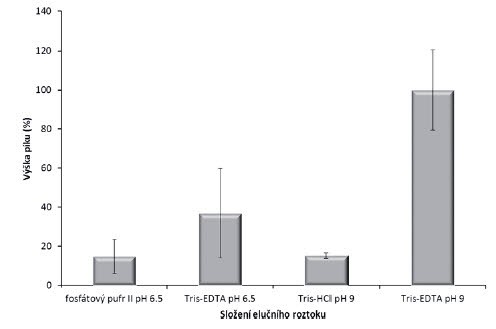
Obr. 2. Vliv složení elučního roztoku na množství izolované DNA
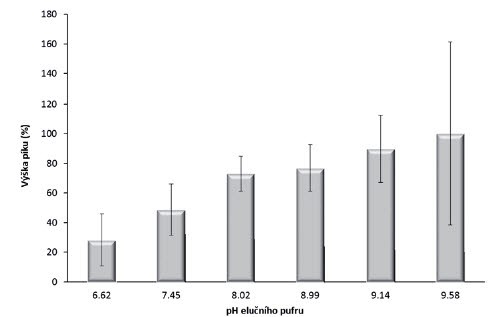
Obr. 3. Vliv pH elučního roztoku Tris-EDTA na množství izolované DNA
Závěr
Byla optimalizována selektivní metoda pro izolaci DNA pomocí magnetizovatelných částic. Tento metodický postup lze využití k urychlení a zjednodušení studia DNA u pacientů s onkologickými onemocněními.
Literatura:
- Gupta AK, Gupta M: Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications. Biomaterials 2005, 26(18):3995-4021.
- Bulte JWM, Kraitchman DL: Iron oxide MR contrast agents for molecular and cellular imaging. NMR Biomed 2004, 17(7):484-499.
- Hsing IM, Xu Y, Zhao WT: Micro- and nano-magnetic particles for applications in biosensing. Electroanalysis 2007, 19(7-8):755-768.
- Berry CC, Curtis ASG: Functionalisation of magnetic nanoparticles for applications in biomedicine. J Phys D-Appl Phys 2003, 36(13):R198-R206.
- Berensmeier S: Magnetic particles for the separation and purification of nucleic acids. Appl Microbiol Biotechnol 2006, 73(3):495-504.
- Kang K, Choi J, Nam JH, Lee SC, Kim KJ, Lee SW, Chang JH: Preparation and Characterization of Chemically Functionalized Silica-Coated Magnetic Nanoparticles as a DNA Separator. J Phys Chem B 2009, 113(2):536-543.
- Cler L, Bu DW, Lewis C, Euhus D: A comparison of five methods for extracting DNA from paucicellular clinical samples. Mol Cell Probes 2006, 20(3-4):191-196.
- Broutian TR, He X, Gillison ML: Automated high throughput DNA isolation for detection of human papillomavirus in oral rinse samples. J Clin Virol 2011, 50(4):270-275.
Poděkování
Tato práce byla vypracována za finanční podpory JMK.
Datum přednesení příspěvku: 19. 4. 2012
