Konference: 2012 XXXVI. Brněnské onkologické dny a XXVI. Konference pro sestry a laboranty
Kategorie: Nádorová biologie/imunologie/genetika a buněčná terapie
Téma: 22. Základní a aplikovaný výzkum v onkologii
Číslo abstraktu: 223
Autoři: Ing. David Hynek, Ph.D.; MVDr. Ludmila Krejčová; doc.RNDr. Pavel Kopel, Ph.D.; Ing. Soňa Křížková, Ph.D.; Mgr. Ondřej Zítka; doc.RNDr. Vojtěch Adam, Ph.D.; doc.RNDr. Libuše Trnková, CSc.; Ing. Jiří Sochor, Ph.D.; prof. RNDr. Marie Stiborová, DrSc.; prof. MUDr. Tomáš Eckschlager, CSc.; doc.Ing. Jaromír Hubálek, Ph.D.; doc.Ing. René Kizek, Ph.D.
Klíčová slova: doxorubicin, ssDNA, square-wave voltametrie, diagnostika
Úvod
Nádorová onemocnění patří k nejzávažnějším zdravotním problémům 21. století. Karcinom prsu a prostaty je nejčastější příčinou úmrtí pacientů. (Risbridger, et al., Lin, et al.) Léčba nádorů nejčastěji zahrnuje operační zákrok, radioterapii a chemoterapii. Při chemoterapii se nejčastěji používají deriváty platiny a antracyklinová antibiotika nebo jejich kombinace. První antracykliny byly izolovány ze Streptomyces peucetius v šedesátých letech a byly nazvány doxorubicin a hydroxyldaunorubicin (obchodní značka Adriamycin) (Minotti, et al.). Doxorubicin,((8S,10S)-10-(4-amino-5-hydroxy-6-methyl-tetrahydro-2H-pyran-2-yloxy)-6,8,11-trihydroxy-8-(2-hydroxyacetyl)-1-methoxy-7,8,9,10-tetrahydrotetracene-5,12-dione), je znám také pod názvem daunomycin nebo adriamycin, a používá se k léčbě řady nádorů. Účinek tohoto léčiva je komplexní, a předpokládá se, že interguje s DNA interkalačním mechanizmem, kdy dochází k inhibici topoisomerázy (Minotti, et al.).
Kiyomia et al. (Kiyomiya, et al.) zkoumali biologický účinek doxorubicinu na nádorové a normální buňky. Z výsledků vyplývá, že účinek spočívá v inhibici syntézy DNA pomocí interkalace a akumulace aktivního kyslíku v nádorových buňkách. Jako všechna antracyklinová léčiva má i doxorubicin nežádoucí vedlejší účinky, z nichž nejobávanější je kardiotoxicita. Vedlejší účinky mohou být významně sníženy vytvořením lipozomálního obalu kolem nanočástic léčiva. (Devalapally, et al.)
Doxorubicin a analogická léčiva obsahují ve své molekule jak chinonové, tak i hydrochinonové skupiny, které skýtají možnost elektrochemické oxidace či redukce. Elektrochemické chování bylo studováno na rtuťových, uhlíkových a různě modifikovaných elektrodách (Riahi, et al.). Na rtuťových elektrodách dochází k redukci chinonové skupiny a karbonylové skupiny na řetězci, což odpovídá dvěma redukčním vlnám. Kromě polarografického studia byla pomocí chronopotenciometrické striping analýzy studována interakce doxorubicinu s DNA. Ke studiu elektrochemického chování doxorubicinu byly rovněž využity elektrody s kombinacemi nanomateriálů. (Vacek, et al., Krizkova, et al.)
Hlavním cílem této práce bylo zkoumání účinku doxorubicinu na různé sekvence oligonukleotidů (ODN) pomocí square-wave voltametrie (SWV).
Experimentální část
Materiál a metody
Chemikálie a příprava vzorků
K experimentům byl použit doxorubicin (TEVA, Česká republika). Sekvence single strand oligonkleotidů (ssODN) s označením GL6, GL4, CA3 a MT5 (viz Tabulka 1.), octan sodný, kyselina octová, voda a další chemikálie v ACS kvalitě byly získány od firmy Sigma Aldrich (USA). Každý ODN se skládá z deseti nukleotidů s různou sekvencí bází. Standardní roztoky oligonukleotidů (10 μg/ml) byly připraveny v ACS vodě a skladovány ve tmě při -20°C. Koncentrace oligonukleotidů byla stanovena spektrofotometricky na spektrofotometru Specord 600 (Analytic Jena, Německo) v křemenných kyvetách a termostatovaném sampleru (20 °C). K přípravě všech roztoků byly použity certifikované pipety (Eppendorf, Německo).
|
Název |
Sekvence |
|
MT5 |
5´-CCAAGACAAA |
|
CA3 |
5´-GCTAAAATCC |
|
GL6 |
5´-AATGTTCCAT |
|
GL4 |
5´-TTTTGTAAAC |
Tabulka 1. Použité sekvence ssODN.
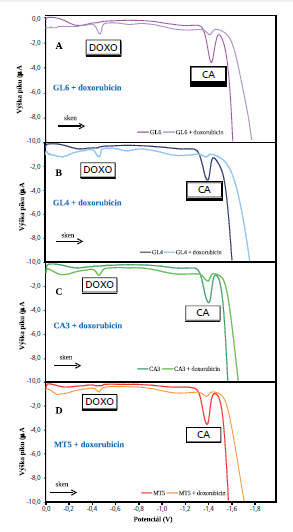 Obr. 1. SW
voltamogramy (A) GL6, (B) GL4,
(C) CA3 a (D) MT5 (0.5 μg/ml) a
jejich směs s doxorubicinem (2.5 μg/ml). Doba interakce 90 min.
Světlé křivky odpovídají směsi oligonukleotidu s do xorubicinem.
Tmavé křivky odpovídají samotnému ssODN oligonukleotidu.
Obr. 1. SW
voltamogramy (A) GL6, (B) GL4,
(C) CA3 a (D) MT5 (0.5 μg/ml) a
jejich směs s doxorubicinem (2.5 μg/ml). Doba interakce 90 min.
Světlé křivky odpovídají směsi oligonukleotidu s do xorubicinem.
Tmavé křivky odpovídají samotnému ssODN oligonukleotidu.
Elektrochemické stanovení
K pozorování interakce doxorubicinu s single strand oligonukleotidy (ssODN) bylo využito elektrochemické metody Square-wave voltametrie (SWV). Měření probíhala na přístroji AUTOLAB PGS30 Analyzer (EcoChemie, Nizozemí), VA-Stand 663 (Metrohm, Švýcarsko) a 797 VA computrace (Metrohm, Švýcarsko) v klasickém tříelektrodové zapojení. Jako pracovní elektroda byla použita visící rtuťová kapková elektroda (HMDE). Referenční elektroda byla Ag/AgCl/3M KCl a srovnávací Pt elektroda. Pro zpracování dat byl použit software GPES 4.9 (EcoChemie, Nizozemí). Jako pomocný elektrolyt byl použit roztok acetátového pufru pH = 5,0. Parametry SWV: počáteční potenciál 0 V, koncový potenciál -1,8 V, potentciálový krok 5 mV, frekvence 280 Hz, doba akumulace 120 s. Analyzované vzorky byly před měřením probublány argonem (99.999 %) po dobu 120 s. Všechny experimenty probíhaly za pokojové-2,0
Výsledky a diskuse
V prvé řadě byl studován vliv koncentrace, doby akumulace a další fyzikálně chemické podmínky chování DNA na elektrodách. Byly použity koncentrace oligonukleotidu (ssODN) od 0,1 do 3,5 μg/ml a doba akumulace 120 s. Redoxní pík cytosinu a adeninu (CA pík) se projeví kolem -1,4 V. Primární sekvence studovaných ssODN (GL6, GL4, CA3, MT5) byla vybrána pro sledování různé polohy adeninu, který je předpokládaným interakčním cílem pro doxorubicin. Získané křivky jsou lineární v rozsahu koncentrací 0,1- 0,75 μg/ml.
MT5, která má tři adeniny na konci a uprostřed řetězce, dává největší CA pík. CA3 se čtyřmi adeniny ve středu řetězce dává druhý největší CA pík. GL4 a GL6, které mají tři adeniny, vykazují píky stejné intenzity. Z toho vyplývá, že intenzita signálu závisí na počtu adeninů v sekvenci, ale nezávisí na poloze v řetězci. V dalším studiu byl sledován vliv primární struktury studovaných ssODN na potenciál píku. SW voltamogramy GL6, GL4, CA3 a MT5 (0.5 μg/ml) jsou na Obr. 1 A, B, C a D. CA píky při potenciálu -1,4 V se mění po přídavku 2,5 μg/ml doxorubicinu (měřeno po 90 min., 400 otáček, 25 °C). Tyto změny souvisí s interakcí doxorubicinu s ssODN. Dochází k poklesu výšky CA píku a objevuje se pík (DOXO) při potenciálu -0,4 V odpovídající doxorubicinu(Hynek, et al.).
Závěr
Elektrochemická analýza se jeví jako vhodná metoda pro studium protinádorového léčiva doxorubicinu s oligonukleotidy (ssODN). Získané výsledky jasně potvrzují interakci doxorubicinu s ssODN. Při této interakci dochází pravděpodobně ke změně distribuce elektronů v molekule DNA a tím ke změnám ve struktuře naměřených voltamogramů. Sekvence použitých ssODN také ovlivňuje naměřený signál a to především mírou a distribucí adeninů v řetězci. Rozdíly v interakci doxorubicinu s různými ssODN naznačují, že cytostatikum může mít relativně selektivní působení na karcinomy se specifickou genetickou změnou. Výsledky budou využity pro cílené specifické působení léčiva na buňky některých nádorů.
Literatura
- Risbridger, G. P., et al., (2010): Breast and prostate cancer: more similar than different, Nature Reviews Cancer, 10: 205-212.
- Lin, S. X., et al., (2010): Molecular therapy of breast cancer: progress and future directions, Nature Reviews Endocrinology, 6: 485-493.
- Minotti, G., et al., (2004): Anthracyclines: Molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity, Pharmacological Reviews, 56: 185-229.
- Kiyomiya, K., et al., (2001): Differences in intracellular sites of action of Adriamycin in neoplastic and normal differentiated cells, Cancer Chemotherapy and Pharmacology, 47: 51-56.
- Devalapally, H., et al., (2007): Role of nanotechnology in pharmaceutical product development, Journal of Pharmaceutical Sciences, 96: 2547-2565.
- Riahi, S., et al., (2010): Computational Modeling of Interaction between Camptothecin and DNA Base pairs, International Journal of Electrochemical Science, 5: 1151-1163.
- Vacek, J., et al., (2009): Ex situ Voltammetry and Chronopotentiometry of Doxorubicin at a Pyrolytic Graphite Electrode: Redox and Catalytic Properties and Analytical Applications, Electroanalysis, 21: 2139-2144.
- Krizkova, S., et al., (2007): A suggestion of electrochemical biosensor for study of platinum(II)-DNA interactions, Electroanalysis, 19: 331-338.
- Hynek, D., et al., (2012): Electrochemical Study of Doxorubicin Interaction with Different Sequences of Single Stranded Oligonucleotides, Part I, Int. J. Electrochem. Sci., 7: 13-33.
Poděkování
Práce byla finančně podpořena projekty CYTORES GAČR P301/10/0356, NANIMEL GAČR 102/08/1546, Liga proti rakovině Praha 2011 a CEITEC CZ.1.05/1.1.00/02.0068.
Datum přednesení příspěvku: 20. 4. 2012
