Konference: 2012 XXXVI. Brněnské onkologické dny a XXVI. Konference pro sestry a laboranty
Téma: 22. Základní a aplikovaný výzkum v onkologii
Číslo abstraktu: 224
Autoři: MVDr. Ludmila Krejčová; Ing. David Hynek, Ph.D.; Ing. Soňa Křížková, Ph.D.; Mgr. Ondřej Zítka; doc.RNDr. Vojtěch Adam, Ph.D.; doc.RNDr. Libuše Trnková, CSc.; Ing. Jiří Sochor, Ph.D.; prof. RNDr. Marie Stiborová, DrSc.; prof. MUDr. Tomáš Eckschlager, CSc.; doc.Ing. Jaromír Hubálek, Ph.D.; doc.Ing. René Kizek, Ph.D.
Klíčová slova: doxorubicin, oligonukleotidy, square-wave voltametrie
Úvod
Doxorubicin byl poprvé izolován na počátku roku 1960 z actinobakterie Streptomyces peucetius ve Farmitalia Research Laboratories of Milane v Itálii. Řadí se mezi nejpoužívanější antracyklinová léčiva používaná pro léčbu maligních tumorů (neuroblastom, myeloidní leukemie, akutní lymfoidní leukemie, Hodkingského lymfom, nádory prsu, plic, močového měchýře a další) (Minotti, et al.). Výhodou tohoto cytostatika je především široká škála použití, nevýhodou je množství vedlejších účinků především jeho kardiotoxicita a vysoké cena (Hynek D).
Doxorubicin (14-hydroxyl-Daunorubicin) vzniká hydroxylací přírodního produktu Daunomycinu (Minotti, et al.). Název této látky pochází z kombinace dvou slov Dauni (kmen obývající Itálii v prerománském období) a rubis (barva léčiva i přírodního produktu je červená). Hlavním mechanismem účinku antracyklinových antibiotik je interkalace do DNA (Kizek R, Thorn, et al.). DNA nemůže být rozpletena, nemůže dojít k replikaci buňky a to jak zdravé, tak nádorové. Mezi další mechanizmy účinků patří inhibice topoizomerázy II (jejíž účinek je relaxace dvoušroubovice před transkripcí), produkce volných radikálů, které poškozují DNA a způsobují lipoperoxidaci membrán – tento mechanismus se uplatňuje při kardiotoxicitě. Dále alkylace a crosslinking DNA. Mezi nežádoucí účinky Doxorubicinu patří nausea, zvracení, arytmie, hematotoxicita, a alopecie. Nejzávažnější je již dříve zmíněná kardiotoxicita (Singal, et al., Patil, et al.). Toxická kumulativní dávka je 550 mg/m2, důsledkem překročení této dávky je zvýšení rizika vzniku dilatační kardiomyopatie. Mechanizmem rezistence buněk k Doxorubicinu je eflux – zvýšená produkce P-glykoproteinu (170 kDa), který má za následek aktivní transport léčiva pryč z buňky.
Pro studium účinku Doxorubicinu na DNA byla zvolena elektrochemická analýza. Při elektrochemických stanoveních dává DNA 2 signály v závislosti na typu nukleotidu. Redukční (adenin a cytosin – CA pík) a oxidační (guanin). V současné době je elektrochemie považována za jednu z nejcitlivějších metod pro studium DNA. Předpokládaným cílem experimentu bylo bližší prozkoumání vlivu pořadí nukleotidů v sekvenci ds oligonukleotidů na interkalaci doxorubicinu do DNA a dále časová závilsost působení doxorubicinu na ds oligonukleotid.
EXPERIMENTÁLNÍ ČÁST Materiál a metody
Doxorubicin byl zakoupen od firmy TEVA (Česká republika). Octan sodný, kyselina octová, voda a další chemikálie byly zakoupené od Sigma Aldrich (USA) v ACS čistotě. Čtyři typy oligonukleotidů a jejich komplementární řetězce byly také zakoupeny od Sigma Aldrich (Tabulka 1). Každý z nich měl jinou sekvenci párů bazí. Standardní roztoky oligonukleotidů byly připraveny ve vodě v ACS kvalitě. Roztoky oligonukleotidů (10 μg/ml) byly připraveny v ACS vodě a uchovávány v temnu při –20 °C. Koncentrace oligonukleotidů byla měřena spektrofotometricky při 260 nm spektrometrem Specord 600 (Analytic Jena, Německo) v křemíkové kyvetě byly vzorky změřeny v termostatovaném karuselu při 20 °C. Pipetování bylo provedeno certifikovanými pipetami (Eppendorf, Německo).
|
název |
sekvence |
název |
sekvence |
název |
sekvence |
název |
sekvence |
|
ds MT5 |
5´- CCAAGACAAA |
ds CA3 |
5´- GCTAAAATCC |
ds GL6 |
5´- AATGTTCCAT |
ds GL4 |
5´-TTTTGTAAAC |
|
3´- GGTTCTGTTT |
3´-CGATTTTAGG |
3´- TTACAAGGTA |
3´-AAAACATTTG |
Tabulka 1 Použité sekvence ss DNA oligonukleotidů a jejich komplementární řetězce.
Příprava ds DNA oligonukleotidů
Výchozím materiálem pro přípravu sledovaných ds DNA oligonukleotidů (ODN) byly komplementární řetězce ss DNA oligonukleotidů (Tabulka 1). Pro párování bází byly zvoleny následující podmínky: 95 °C, 15 minut, 400 rpm. Následně byla směs komplementárních ssDNA pomalu ochlazena na teplotu 25 °C.
Příprava reakčních směsí dsDNA oligo s Doxorubicinem
Pro sledování interakce doxorubicinu s DNA byl zvolen poměr koncentrace oligo: doxorubicin 1:1. Měření probíhala kontinuálně v průběhu inkubace po dobu 5 hodin. První hodinu bylo měření prováděno v 15 minutových intervalech, následující 4 hodiny v 30 minutových intervalech.
Square-wave voltametrie
Ke sledování interakcí doxorubicinu s DNA bylo využito elektrochemické techniky square-wave voltametrie (SWV). K měření bylo využito následující instrumentace: AUTOLAB PGS30 Analyzer (EcoChemie, Nizozemí) připojený k 663 VA Stand (Metrohm, Švýcarsko). Měření probíhalo v klasickém tříelektrodovém zapojení v prostředí acetátového pufru (pH 5,0). Pracovní elektroda byla rtuťová (HMDE), referenční argentrochloridová (Ag/AgCl/3M KCl) a pomocná elektroda byla platinová. Parametry Square-wave voltametrie (SWV): potenciálový krok 5 mV, frekvence 280 Hz, čas akumulace 120 s, měřené vzorky byly kvůli odstranění kyslíku probublávány argonem (99,999%). Všechna měření probíhala při teplotě 25 °C. K vyhodnocení záznamů byl použit software GPES 4.9 (EcoChemie).
Výsledky a diskuse
Cílem studie bylo zjistit způsob chování doxorubicinu při interkalaci do krátkých úseků DNA (ds oligonukleotidů). Byly navrženy celkem čtyři rozdílné sekvence. Čtyři různé varianty oligonukleotidů byly navrženy z důvodu affinity doxorubicinu k adeninu a guaninu. Druhým sledovaným parametrem byla časová závislost působení doxorubicinu na ds oligonukleotidy. Získané experimentální výsledky jsou shrnuty na Obrázku 1. Experimentální výsledky byly hodnoceny jako korelace mezi signály CA píku a píku doxorubicinu. Procentuální změna velikosti CA piku ve směsi oligonukleotid-doxorubicin byla vztažena k referenční hodnotě velikosti píku samotného dsODN. Procentuální změna velikosti píku DOXO ve směsi oligonukleotid-doxorubicin byla vztažena k maximální hodnotě velikosti píku v dané časové závislosti. Ze získaných dat byly vyhotoveny korelační závislosti ukazující změny velikosti píku DOXO na změně velikosti píku jednotlivých dsODN. Do navržené závislosti byla ještě vnesena časová linie (čas interakce DOXO s dsODN) 30, 150, 240 a 300 min. Hodnota [100;0] prezentuje počáteční stav elektrochemické analýzy, čili stav kdy je provedeno pouze měření dsODN. Tento bod je nutno chápat jako počátek pro všechny čtyři uvedené oligonukleotidy (MT5d, GL6d, GL4d a CA3d).
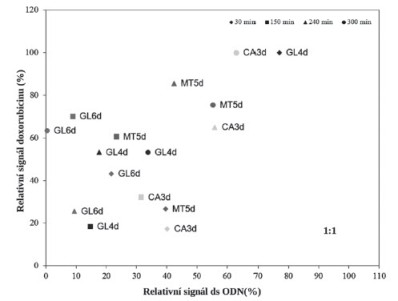
Obr. 1. Relativní signál doxorubicinu jako funkce relativního signálu ds oligonukleotidu při koncentračním poměru 1:1.
Směs oligonukleotid-doxorubicin smíchaná v poměru 1:1 poskytuje ve výše uvedených souřadnicích obrázek chování jednotlivých dsODN. Na obrázku je vidět horizontální časová posloupnost pro oligonukleotid CA3d (nejníže jsou hodnoty pro 30 min. (nízký obsah doxorubicinu v dsODN, při poklesu signálu píku CA o 60 %). S rostoucím časem však došlo k rychlému nárůstu signálu DOXO s relativním signálem CA kolem 65 % kontrolní dsODN. Velmi podobné je umístění hodnot pro dsODN MT5d, tento ODN vykazuje výrazný pokles signálu CA píku o 80 % kontrolní dsODN. V dalším časovém průběhu se signál DOXO a CA pík příliš nemění. Je patrné, že dsODN GL6d vykazuje nejvýraznější změny v elektrochemickém chování. Body dsODN GL6d jsou v diagramu posunuty nejvíce vlevo – pokles velikosti signálu CA píku je o 85 %. Následně dochází k dramatickému nárůstu signálu DOXO a mírnému rozvinutí struktury dsODN. Následně je pak dsODN charakterizován asi 50 % signálem DOXO a 60-80 % poklesem signálu CA píku. Velmi výrazná interakce byla pozorována u dsODN GL6 charakterizována až úplným vymizením signálu CA píku. Přes tuto silnou interakci byly maximální hodnoty DOXO signálu v rozmezí 40-80 %. Změna signálu jednotlivých oligonukleotidů nesouvisí jen s pořadím jednotlivých nukleotidů v řetězci. Velmi podstatnou součástí interkalace je vliv času na působení doxorubicinu na DNA. Změny v signálech oligonukleotidů je třeba sledovat komplexním pohledem a vzít na vědomí, že během interakce doxorubicinu s DNA pravděpodobně dochází ke změně struktury DNA.
Závěr
Naše výsledky ukazují (Hynek D), že interakce mezi dsODN a doxorubicinem je velmi složitý fyzikálně-chemický děj. Vznikající změny, které byly elektrochemicky sledovány, pravděpodobně souvisí se změnou sekundární, případně dalších struktur studovaných dsODN, a také pravděpodobně se způsobem interakce samotného doxorubicinu s dsDNA. V případě interakce doxorubicinu s ds DNA dochází k interkalaci – tedy vmezeření doxorubicinu do struktury DNA. V současné době se stále častěji používají enkapsulované formy doxorubicinu. Protože doxorubicin je nepostradatelnou součástí léčby výše zmíněných nádorových onemocnění je nezbytné detailně objasnit mechanismy jeho interakce s DNA.
Literatura:
- Minotti, G., et al., (2004): Anthracyclines: Molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity, Pharmacological Reviews, 56: 185-229.
- Hynek D, K. L., Adam V, Trnkova L, Sochor J, et al., (2011): Study of Antitumor Drugs Doxorubicin Interaction with Different Sequence Single Strand Oligonucleotide – Part I., Int J Electrochemical Sci, 8:
- Kizek R, A. V., Hrabeta J, Eckschlager T, Smutny S, et al., (2011): Anthracyclines and ellipticines as DNA-damaging anticancer drugs, Recent advances Pharmacology Therapeutics submision,
- Thorn, C. F., et al., (2011): Doxorubicin pathways: pharmacodynamics and adverse effects, Pharmacogenetics and Genomics, 21: 440-446.
- Singal, P. K., et al., (1998): Doxorubicin-induced cardiomyopathy, New England Journal of Medicine, 339: 900-905.
- Patil, R. R., et al., (2008): Engineered nanocarriers of doxorubicin: A current update, Critical Reviews in Therapeutic Drug Carrier Systems, 25: 1-61.
- Hynek D, K. L., Zitka O, Adam V, Trnkova L, Sochor J, et al., (2012): Electrochemical Study of Doxorubicin Interaction with Different Sequences of Double Stranded Oligonucleotides, Part II, Int. J. Electrochem. Sci., 7: 34-49.
Poděkování
Práce byla finančně podpořena projekty CYTORES GAČR P301/10/0356, NANIMEL GAČR 102/08/1546, Liga proti rakovině Praha 2011 a CEITEC CZ.1.05/1.1.00/02.0068.
Datum přednesení příspěvku: 20. 4. 2012
